Kristalizayon,
homojen bir faz içinde katı partiküllerin oluşmasıdır. Örneğin, bir buhar
içinde (kar gibi) katı taneciklerin oluşması, büyük tek kristallerin üretiminde
sıvı bir ergiyikten katılaşma veya sıvı çözeltiden kristalizasyon tipik
örneklerdir. Bu bölümde özellikle sıvı çözeltiden kristalizasyon üzerinde
durulacaktır.
Çözeltiden
kristalizasyon, kristal formda malzemelerin çeşitliliğine olanak verdiğinden
endüstriyel yönden oldukça önemlidir. Bunun nedeni iki temele dayanır:
Birincisi saf olmayan bir çözeltiden oluşan bir kristal, kristal karışımları
karışımları halinde bulunmadıkça, saftır. Diğeri, uygun koşullar için,
paketlenip depolandığında saf kimyasal maddelerin elde edilmesinde pratik bir
yöntemdir.
Magma: Endüstriyel olarak çözeltiden
kristalizasyonda, ana sıvı ve çeşitli boyutlardaki kristallerin iki-fazlı
karışımına ‘magma’ denir; magma, kristalizörden ürün olarak çekilir.
Bir kristal, cansız maddeler arasında en
yüksek organize tipe sahip bir maddedir. Kristal, uzam (mekan) latisleri
denilen düzenli üç-boyutlu dizilerde düzenlenmiş oluşturucu (kurucu)
partikülleriyle, -ki bunlar atomlar, moleküller veya iyonlardır-karakterize
edilir. Partiküllerin böyle düzenlenmelerinin bir sonucu olarak, kristaller
oluşmaya bırakıldığında (dış etkenler ve diğer kristallerin etkilerinin
olmadığı koşullarda) polihedron formunu alır; keskin köşelere ve düz kenarlara
veya yüzeylere sahiptir. Aynı malzemenin çeşitli kristallerinin tüm kenar ve yüzey
boyutları relatif olarak farklı olmasına rağmen, uygun yüzeylerin oluşturduğu
açılar eşittir ve aynı malzemeyi karakterize eder.
Kristalografik
Sistemler: Belirli bir substansın (madde, cisim, ..) tüm kristalleri,
bireysel yüzeylerinin farklılığına rağmen, aynı arayüzey açısına sahiptir;
kristal formları bu açılar temel alınarak sınıflandırılır. Yedi kristal formu:
kübik, heksagonal, trigonal, tetragonal, ortorombik, monoklinik ve
trikliniktir. Bir malzeme, kristalizasyon koşullarına bağlı olarak iki veya
daha fazla farklı sınıfta kristallenebilir. Örneğin, kalsyum karbonat doğal
olarak genellikle heksagonal formda (kalsit) bulunurken, ortorombik formu
(aragonit)) da vardır.
Değişmeyen
Kristaller: İdeal koşullar altında, büyüyen bir kristal geometrik benzerliğini
korur; böyle bir kristale ‘değişmeyen (invaryant)’ denir. Şekil-1’de, değişmeyen
bir kristalin büyüme esnasındaki enine kesiti görülmektedir; her bir poligon
farklı zamanlardaki kristal taslağını tanımlar. Kristal değişmeyen olduğundan
bu poligonlar geometrik olarak benzerdir ve poligonların köşelerini kristalin
merkeziyle birleştiren noktalı çizgiler düzdür. Merkez noktanın, kristalin
büyümeye başladığı orijinal çekirdeğin bulunduğu yer olduğu kabul edilebilir.
Herhangi bir yüzün büyüme hızı kristalin merkezinden, yüze dik bir yönde
yüzeyin geçiş hızıyla ölçülür. Kristal muntazam bir polihedron olmadıkça
invaryant bir kristalin çeşitli yüzlerinin büyüme hızları eşit olmaz.
Kristal
Boyutu ve Biçim (Şekil) Faktörleri: Herhangi bir biçimdeki invaryant bir
kristalin boyutunu ölçmek için tek bir boyut kullanılabilir. Bir kristalin
toplam yüzey alanının (sp), kristal hacmine (vp) oranı,
¾ = ¾¾ (1)
vp Fs Dp
Fs =
küreselliktir. Bir kristalin karakteristik uzunluğu L, FsDp’ye
eşit olarak tanımlanırsa,
L = Fs Dp ¾¾ (2)
sp
küpler ve küreler için Fs = 1
ve L = Dp’dir.
Geometrik katılar için, genellikle L, taramayla tayin edilen boyuta yakındır.
Kristalizasyon saflık, verim, enerji
gereksinimleri, çekirdeklenme ve büyüme bakış açılarıyla analizlenebilir.
Ürün
Saflığı: İyi oluşan bir kristal tamamen saflığa yakın bir formdadır. Ancak
son magmadan* çekildikten sonra ana sıvıyı tutar, dolayısıyla çok az safsızlık
içerir. Pratikte kristalde kalan ana sıvı süzme veya santrifüjle uzaklaştırılır,
temiz solventle yıkanır. Bu saflaştırma aşamaları kristalin boyutu ve
düzenliliğine bağlı olarak yapılır. (*Magma: ana sıvı ve çeşitli boyutlardaki
kristallerin iki-fazlı karışımı)
Denge ve Verimler
Kristalizasyon
prosesinde çözelti doygun hale geldiğinde dengeye ulaşılır; kütle (bulk)
kristaller için denge ilişkisi çözünürlük eğrisidir. Çok küçük kristallerin
çözünürlüğü, normal boyutlarda olanlara kıyasla daha büyüktür. Çözünürlük verileri
standart tablolarda verilmiştir. Şekil-2’de sıcaklığın fonksiyonu olarak çözünürlük
eğrileri görülmektedir. Pek çok malzeme, KNO3 (1) eğrisine benzer
eğriler verir; çözünürlükleri sıcaklıkla az veya çok artar. Az sayıda substans,
NaCl (2)’ye benzer eğriler izler; sıcaklıkla çözünürlük çok az değişir.
Pek çok inorganik bileşik, kristalizasyon
suyu ile kristallenir (hidratlar). Bazı sistemlerde birkaç farklı hidrat
oluşur; bu durum konsantrasyon ve sıcaklığa, komplike sistemlerde faz dengesine
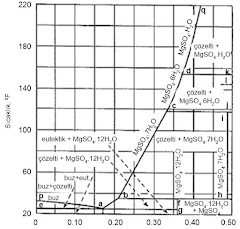
bağlıdır. Örnek olarak magnezyum sülfat-su sistemi için faz diyagramı
Şekil-3’de verilmiştir. Diyagramda susuz magnezyum sülfatın (kütle fraksiyonu)
konsantrasyonuna karşı denge sıcaklığı (0F) verileri görülmektedir.
Yukarıdaki ve kırık hattın soluna doğru olan tüm alan, suda magnezyum sülfatın
doygunluk altındaki çözeltilerini tanımlar.
Verimler:
Endüstriyel kristalizasyon proseslerin çoğunda kristaller ve ana sıvı, dengeye
ulaşılabilecek yeterli süre boyunca temastadır; ana sıvı, işlemin sonunda
doygun hale gelir. Prosesin verimi, orijinal çözeltinin konsantrasyonu ve son sıcaklıktaki
çözünürlüğünden hesaplanabilir. Proses sırasında hissedilir derecede buharlaşma
oluyorsa, bunun bilinmesi önemlidir.
Kristal büyüme hızı yavaş olduğunda dengeye
ulaşılması için oldukça uzun zamana gerek vardır. Böyle bir durumla özellikle,
çözeltinin viskoz olması veya kristallerin kristalizörün tabanında birikmesi ve
süperdoygun çözeltiyle temastaki kristal yüzeyinin azalması halinde
karşılaşılır. Bu gibi hallerde son ana sıvı süperdoygun halde kalır ve gerçek
verim, çözünürlük eğrisinden hesaplanan değerden daha küçük olur.
ÖRNEK-1:
%30 MgSO4 ve %70 su içeren bir çözelti 60 0F’a
soğutuluyor. Soğutma sırasında toplam suyun %5’i sistemde buharlaşıyor.
Orijinal karışımın kilogramı başına kaç kg kristal kristal elde edilir?
Çözüm:
(Şekil-3’ten)
ana sıvının konsantrasyonu: %24.5 MgSO4 ve %75.5 H2O
1000 kg orijinal çözeltide toplam su: 0.70 x 1000 = 700 kg
buharlaşma: 0.05 x 700 = 35 kg
MgSO4 molekül ağırlığı: 120.4
MgSO4.7H2O molekül ağırlığı: 246.5
yığındaki (batch) toplam MgSO4.7H2O: 1000 x 0.30 (246.5/120.4) = 614 kg
yığındaki (batch) serbest su: 1000 – 35 – 614 = 351 kg
100 kg ana sıvıdaki MgSO4.7H2O: 24.5 (246.5/120.4) = 50.16 kg
100 kg ana sıvıdaki serbest su: 100 – 50.16 = 49.84 kg
ana sıvıdaki MgSO4.7H2O: (50.16/49.84) 351 = 353 kg
son ürün (crop): 614-353 = 261 kg
Entalpi
Dengeleri: Kristalizörlerde ısı dengesi hesaplamalarında kristalizasyon
ısısı önemlidir. Bu, bir çözeltiden katı oluştuğunda çıkan gizli ısıdır (latent
heat). Kristalizasyon ekzotermik bir olaydır, ve kristalizasyon ısısı sıcaklık
ve konsantrasyonla değişir. Kristalizasyon ısısı, doygun bir çözeltide
kristallerin absorbladığı ısıya eşittir; bu değer, büyük miktarda bir
solventteki çözelti ısısından ve doygunken seyreltilen çözeltinin seyrelme
ısısından hesaplanabilir. Çözelti ısıları ve seyrelme verileri vardır; bunlar,
kristallerin ve çözeltilerin spesifik ısıları verileriyle birlikte
entalpi-konsantrasyon grafiklerinin hazırlanmasında kullanılabilir.
MgSO4 ve su sistemi için katı
fazların entalpilerini gösteren bir H-x diyagramı Şekil-4’de görülmektedir. Bu
diyagram Şekil-3’teki faz diyagramıyla uyumludur. Entalpiler Btu/lb olarak
verilmiştir ve karışımdaki faz sayısından bağımsız olarak 1 lb toplam karışımı
ifade eder.
· eap alanı: buz ve donmuş MgSO4 çözeltilerinin tüm denge karışımlarını ifade eder. n noktası 32 0F’da buza aittir.
· aeg izotermal (25 0F) üçgen: katılaşmış eutektik veya kısmen katılaşmış eutektik MgSO4.12H2O kristalleriyle buzun tüm kombinasyonlarının entalpilerini verir.
· abfg alanı MgSO4.12H2O kristalleri ve ana sıvı içeren tüm magmalar için entalpi-konsantrasyon noktalarını verir.
· bhf izotermal (35.7 0F) üçgen: MgSO4.7H2O’nun MgSO4.12H2O’ya transformasyonu gösterir; %21 MgSO4,doygun çözeltisi, katı MgSO4.7H2O ve katı MgSO4.12H2O karışımlarını kapsar.
· cihb: MgSO4.7H2O ve ana sıvının tüm magmalarına aittir.
· cji izotermal (118.8 0F) üçgeni: %33 MgSO4,doygun çözeltisi, katı MgSO4.6H2O ve katı MgSO4.7H2O karışımlarını kapsar.
· dljc: MgSO4.6H2O ve ana sıvının entalpilerini gösterir.
· dkl izotermal (154.4 0F) üçgeni: %37 MgSO4,doygun çözeltisi, katı MgSO4.H2O ve katı MgSO4.6H2O karışımlarını kapsar.
· qrkd alanı: MgSO4.H2O ile dengedeki doygun çözeltilerdir.
ÖRNEK-2: Batch bir kristalizörde 120 0F (48.9 0C) sıcaklıkta %32.5’luk MgSO4 çözeltisi, su-soğutmalı bir kristalizörde (batch) önemli seviyede buharlaşma olmaksızın, 70 0F (21.1 0C)’ye soğutulmaktadır. Ton kristal için çözeltiden ne kadar ısı uzaklaştırılmalıdır?
Çözüm:
Başlangıç çözeltisiŞekil-4’deki 120 0F izotermi üzerinde
altdoygun-çözelti alaında 0.325 konsantrasyondaki noktadır. Bu noktanın 0.325
konsantrasyonda entalpi koordinatı -33.0 Btu/lb’dir. Son magma için nokta cihb
alanında 70 0F izotermi üzerindedir. Bu noktanın entalpi koordinatı
-78.4’dür. Orijinal çözeltinin her 100 poundu için çözeltinin entalpi değişimi,
100 (33.0 – 78.4) =
-4540 Btu
Bu, 4540 Btu/100 lb (1.06 x 105
J/kg) ısı çıkışıdır.
Son slurynin (bulamaç) kristaller ve ana sıvı
bazında paylaşımında ‘merkez-gravite prensibi’nden yararlanılır; buna göre, iki
fazlı bir karışımda fazların kütleleri, konsantrasyonları arasındaki farkla
ters orantılıdır. Şekil-4’de 70 0F’daki izoterme uygulandığında ana
sıvının konsantrasyonu 0.259, kristallerin 0.488 olarak bulunur. Kristallerin
miktarı,
0.325 – 0.259
100 ¾¾¾¾¾¾¾¾ = 28.8 lb/100 lb slury
0.488 – 0.259
Her ton kristal için çıkan ısı:
Süperdoygunluk:
Bir çözeltiden kristalizasyon, homojen bir karışım içinde yeni bir fazın
yaratılmasıdır. Olay iki aşamada gerçekleşir. Birincisi kristal oluşmasıdır;
buna çekirdeklenme prosesi denir. İkincisi ise kristalin büyümesidir. Her iki
aşama için de yürütücü potansiyel süperdoygunluktur; doygun veya altdoygun
(undersaturasyon) bir çözeltiden çekirdeklenme de kristal büyümesi de oluşamaz.
Teorik
Süperdoygunluk, üç metottan biri veya daha fazlasıyla meydana getirilebilir. Solutun çözünürlüğü sıcaklık yükselmesiyle kuvvetle artarsa-çoğu inorganik tuzlar ve organik substanslarla olduğu gibi-sıcaklığın düşürülmesi ve soğutmayla doygun çözelti, süperdoygun hale dönüşür. Çözünürlük sıcaklığa bağlı değilse-bazı yaygın tuzlarla olduğu gibi-süperdoygunluğa, solventin bir kısmının buharlaştırılmasıyla ulaşılır. Ne soğutma ve ne de buharlaştırma istenmediği durumlarda-çözünürlük çok yüksek olduğu haller-süperdoygunluk, üçüncü bir komponent ilavesiyle yaratılabilir. Üçüncü komponent fiziksel etkileşimle orijinal solventle, solventin çözünürlüğünün hızla azaldığı karışık bir solvent oluşturur. Bu proses ‘tuzlama’ denir. Yaklaşık olarak tam bir çökelme istendiğinde, orijinal solutla etkileşerek çözünmeyen bir substans veren üçüncü bir komponent ilavesiyle yeni bir solut yaratılabilir. Buna ‘çöktürme prosesi’ denir. Üçüncü bir komponent ilavesiyle çok büyük süperdoygunluklar hızla elde edilebilir.
Süperdoygunluk
Birimleri: Süperdoygunluk, kristalin kristalin büyüdüğü süperdoygun çözelti
ve kristalle dengedeki bir çözeltinin arasındaki konsantrasyon farkıdır. İki
faz hemen hemen aynı sıcaklıktadır. Konsantrasyon, ya solutun mol kesriyle (y)
veya birim çözelti hacimdeki solut molü (c) ile tanımlanabilir. Faz sınırları
boyunca sadece bir komponent transfer edilir. İki süperdoygunluk,
y = çözeltideki solutun mol kesri
ys = doygun çözeltideki solutun mol kesri
Dc = molar süperdoygunluk, mol/hacim
c = çözeltideki solutun molar konsantrasyonu
cs = doygun çözeltideki solutun molar konsantrasyonu
Denklem (3) ve (4) ile tanımlanan
süperdoygunluklar Denklem (5)’teki ilişkidedir:
Dc = rM y – rs ys (5)
rM çözeltinin yoğunluğu ve rs doygun çözeltinin yoğunluğudur. Kristalizörlerde süperdoygunluk genel
olarak küçük olduğundan rM ve rs eşit kabul edilir; her ikisi için de rM değeri kullanılır.
Dc = rM Dy (6)
Konsantrasyon oranı a ve fraksiyonal süperdoygunluk s:
c Dc y Dy
a º ¾ = 1 + ¾¾ = ¾ = 1 + ¾¾ º 1 + s (7)
cs cs ys ys
Sıcaklık
Farkının Etkisi: Çözünürlük sıcaklıkla önemli derecede değiştiğinde
süperdoygunluk, konsantrasyon farkı yerine eşdeğer bir sıcaklık farkıyla
verilir. Bu yürütücü potansiyeller arasındaki ilişki Şekil-5’de verilmiştir.
Hattın üstündeki alan doymamış çözeltileri, altındaki alan süperdoygun
çözeltileri gösterir. A noktası Tc sıcaklığında doymuş bir çözeltiye
aittir; büyüyen kristallerin sıcaklığıdır. D noktası, T sıcaklığındaki
süperdoygun çözeltiyi ifade eder. Kristal büyürken ısı çıktığından Tc
T’den biraz büyüktür; dolayısıyla, kristalden sıvıya ısı transferi için DTh kadar yürütücü kuvvet meydana
gelir. Bu sıcaklık farkı, tipik olarak 0.01-0.02 0C seviyesindedir.
Süperdoygunluk a normal olarak bulk
(kütle) sıcaklığına bağlıdır; E ve D noktalarında gösterildiği gibi, gerçek
süperdoygunluktan biraz daha büyüktür.
B noktası, kristalin büyüdüğü süperdoygun
çözelti ile aynı konsantrasyonda doymuş bir çözeltiyi gösterir; sıcaklığı Ts’dir,
Ts > T. C noktası Tc sıcaklığını ve süperdoygun
çözeltinin konsantrasyonuna eşit bir konsantrasyonu tanımlar.
Denklem (3) ve (4)’den süperdoygun potansiyel
AC hattıyla gösterilmiştir. Eşdeğer sıcaklık hattı BC’dir. Çözünürlük eğrisinin
AB bölümünün, AC hattının küçük konsantrasyonlarında doğrusal olduğu
düşünülebilir; sıcaklık potansiyeli,
DT º Ts – Tc = k (y – ys)
= k Dy = k/rM Dc (8)
k = T – y hattının eğimi, rM = molar
yoğunluktur.
Sıcaklık
potansiyeli bu nedenle, çözeltinin gerçek sıcaklığı T’den ve doygunluk
sıcaklığı Ts’den hesaplanandan biraz daha azdır. DTh çok küçük olduğundan Ts
– T ve Ts – Tc genellikle önemsizdir.
Çekirdeklenme
Çekirdeklenme hızı, birim magma (veya
katı-içermeyen ana sıvı) hacmi başına birim zamanda oluşan yeni partiküllerin
sayısıdır. Bu değer kristal boyut dağılımını (CSD, crystal size distribution)
kontrol eden ilk kinetik parametredir.
Kristalizörlerdeki
Kristallerin Kökenleri (Orijinleri): Tüm partiküllerin kaynağı
çekirdeklenme terimi altında sınıflandırılırsa, bir dizi çekirdeklenme olayı
meydana gelebilir. Gerçekte, çekirdeklenme üç grup altında toplanabilir;
2. Birincil (primer) çekirdeklenme
3. İkincil (sekonder) çekirdeklenme
Kristallerin orijini makroskopik yıpranma
veya aşınmadır; gerçek çekirdeklenmeden daha çok ufalanmaya benzer. Sirküle
magma kristalizörlerde dahili propeller çalkalayıcılar veya harici sirkülasyon
pompaları bulunur. Bu hareketli parçalara çarpan yumuşak veya zayıf kristaller
kırılır, yuvarlak köşeli ve kenarlı büyük küçük yeni kristtaller oluşur, ürünün
kalitesi bozulur. Yıpranma süperdoygunluğa bağlı değildir.
Deneysel çalışmalarda kristalizasyon
sistemine ‘tohumlar’ ilave edilir; bunlar yüzeylerinde çok sayıda küçük
kristaller taşır. Küçük kristaller hemen yıkanarak alınır ve süperdoygun
çözeltide büyürler; buna ‘ilk ıslah ‘başlangıç ıslahı (initial breeding)’
denir. Tohum kristallerin kullanılmadan önce kürlenmemesi için gerekli önlemler
alınmalıdır.
Yapay çekirdeklenme, geniş süperdoygunluklar
veya zayıf magma sirkülasyonlarında oluşur. Kristallerin sonlarında iğnemsi
anormal büyümeler görülür; bu oluşumlar esas kristale zayıf bağlarla eklenerek
kristali koparır ve kalitesini bozar. Buna ‘iğne ıslahı (needle breeding)’
denir.
‘Kısıtlı veya kapalı büyüme’, orta derece
süperduygunluklarda oluşa diğer bir kusurlu büyüme formudur. Nedeni, anasıvının
kristal yüzeyi içinde sıkışmasıdır; sütlü görünümlü, saf olmayan bir formdur.
Şeki6 ve Şekil-7 MgSO4.7H2O
için çeşitli büyüme formlarını ve çekirdeklenme tipi ve kristal büyümesinde
süper doygunluğun etkisi gösterilmiştir.
Primer
Çekirdeklenme: Bilimsel uygulamalarda çekirdeklenme, mevcut süperdoygun
homojen bir faz içinde yeni bir fazda çok küçük oluşumların (body) doğmasıdır.
Temel olarak çekirdeklenme fenomeni, çözeltiden kristalizasyon, bir ergiyikten
kristalizasyon, aşırısoğumuş bir buharda sis damlalarının kondensasyonu,
süperısınmış bir sıvıda kabarcıklar meydana gelmesiyle aynı olaydır. Her durumda
çekirdeklenme, metastabil dengedeki homojen bir fazda hızlı bir dalgalanmanın
(moleküler skalada) sonucudur; buna ‘homojen çekirdeklenme’ denilmektedir.
Farklı bir çekirdeklenme prosesi, ‘heterojen
çekirdeklenme’ prosesidir. Değişik substansların katı partiküllerinin
çekirdeklenme prosesini katalizleyerek çekirdeklenme hızını artırdığı bir
prosestir.
Homojen
Çekirdeklenme: Çözeltiden kristalizasyonda, bazı çökelme reaksiyonları
hariç, homojen kristalizasyon hemen hemen hiç gerçekleşmez. Ancak çekirdeklenme
tiplerini anlayabilmek için çekirdeklenme olayının temellerinin anlaşılması
önemli ve gereklidir.
Kristal çekirdekleri çeşitli partiküllerden
oluşabilir; moleküller, atomlar veya iyonlar gibi. Bunlar sulu çözeltilerde
hidratlanabilir. Hareketleri rastgele olduğundan, bu partiküllerin birkaç
tanesi küçük bir hacimde ‘cluster (küme)’denilen yapılaşma oluşturabilir;
bunlar, kolayca kaybolan zayıf birleşmelerdir (agregasyon). Yeterli sayıda
partiküller biraraya geldiğinde ise ‘embriyo’ olarak tanımlanan bir yapıda
toplanabilir; bu durum bir latis düzeninin başlangıcı olup, yeni ve ayrı bir
fazın oluşumuna yol açar. Çoğu koşulda embriyoların yaşam süresi kısadır ve
clusterlere veya bireysel partiküllere dönüşür. Ancak süperdoygunluğun yeteri
kadar büyük olduğu hallerde bir embriyo, çözeltiyle termodinamik dengeye
gelebilecek bir boyuta kadar büyüyebilir; buna ‘çekirdek’ denilmektedir.
Çekirdek, en küçük partiküller topluluğudur, içerdiği partiküller
birbirlerinden ayrılmaz; bir kristal oluşturacak şekilde büyüyebilir. Kararlı
bir çekirdek için gerekli partikül sayısı birkaç taneden yüzlerce taneye kadar
değişebilir. Sıvı su için bu sayı 80 dolayındadır.
Çekirdekler kararsız
bir denge halindedir: birimlerini kaybeden bir çekirdek çözünürken, yeni
birimler kazanan bir çekirdek kristal forma dönüşür. Buna göre bir kristalin
oluşum aşamaları aşağıda gösterildiği şekilde tanımlanabir:
Cluster¾® Embriyo ¾® Çekirdek ¾® Kristal
Denge: Termodinamik olarak, aynı sıcaklıkta küçük ve büyük bir partikül arasındaki fark, yüzey enerjisidir (birim kütle için); küçük partikülde önemli miktarda yüzey enerjisi olduğu halde, büyük partikülde yoktur. Bu durumun bir sonucu, küçük bir kristalin (mikrometre boyutundan daha küçük) çözünürlüğünün, büyük bir kristalden daha büyük olmasıdır. Genel çözünürlük verileri sadece orta derece büyüklüklerdeki kristallere uygulanabilir. Küçük bir kristal aşırıdoygun (süperdoygun) bir çözeltiyle denge halinde bulunabilir. Böyle bir denge kararsızdır; çünkü çözeltide büyük bir kristalin de bulunması halinde küçük olan kristal çözünecek ve tamamen yok oluncaya kadar büyük olan büyüyecektir. Bu fenomen ‘Ostwald Ripening (Ostwald Olgunlaşması)‘ olarak tanımlanır. Çözünürlükte partikül boyutunun etkisi, çekirdeklenmedeki anahtar faktörlerden biridir.
Kelvin
Eşitliği
Bir substansın çözünürlüğü partikül boyutuyla
ilişkilidir; Kelvin eşitliğine göre,
4VM s
ln a = ¾¾¾ (9)
n
RTL
a = süperdoygun ve doygun çözeltilerin konsantrasyonlarının oranı
VM = kristalin molar hacmi
s = katı ve sıvı arasındaki ortalama yüzeyarası gerilim
n = (iyonların sayısı) / (solut molekülü); moleküler kristaller için n = 1
Çekirdeklenme
Hızı: Kimyasal kinetik teorisinden, çekirdeklenme hızı aşağıdaki eşitlikle
verilir:
16p V2M Na s3
B0 = C eksp [- -¾¾¾¾¾¾¾¾ ] (10)
3(RT)3 v2
(ln a)2
Na = Avagadro sabiti, 6.0222.1023 molekül/g.mol
R = gaz sabiti, 8.3143 x 107 erg/g.mol-K
C = frekans faktörü
C faktörü, kritik boyuta ulaşan embriyoların
oluşum hızının statistik bir ölçüsüdür. Bireysel partiküllerin
konsantrasyonuyla ve kararlı bir çekirdek oluşturmak için gerekli kritik
boyuttaki bir embriyoyla bu partiküllerin çarpışma hızıyla orantılıdır. Çözeltilerden
çekirdeklenme için değeri bilinmiyor, ancak, aşırıdoygun su buharından su
damlalarının oluşumunda (çekirdeklenme benzeşimi),
C » 1025
çekirdek/cm3-s
dolayındadır. C faktörünün doğru değerinin
bilinmesi önemli değildir; çünkü, çekirdeklenme kinetiğinde eksponentteki a terimi baskındır.
B0 eşitliğindeki s değeri de belirsizdir. Katı-sıvı yüzey
arası gerilimlerin deneysel olarak saptanması zordur ve çok az veri mevcuttur.
Latis (şebeke, örgü) enerjilerin kullanıldığı katı-hal teoriden tahminler yapılabilir.
Sıradan tuzlar için s, 80-100 erg/cm2’dir.
Denklem(10) da, yukarıdaki C ve s
değerleri kullanıldığında s için bir değer hesaplanabilir. Bu değer bir
çekirdeğin 1/(cm3 saniye) deki çekirdeklenme
hızını gösterir, veya B0 = 1 dir. Hesaplanan s değeri çok büyüktür
ve olağan çözünürlükteki malzemeler için mümkün değildir; bu nedenle,
çözeltiden kristalizasyonda homojen çekirdeklenme asla meydana gelemez, bu
koşullarda tüm gerçek çekirdeklenmeler heterojendir. Sonuç olarak Denklem(10)
gerçek çekirdeklenme hızlarını vermez.
Heterojen
Çekirdeklenme: Katı partiküllerin, çekirdeklenme hızı üzerindeki katalitik
etkisi, çekirdeklenme için gerekli enerjiyi düşürür. Bu etkiyle ilgili bir
teoriye göre çekirdek katalistin yüzeyini ıslatıyorsa çekirdeğin oluşum işi,
çekirdek ve katalist arasındaki açının fonksiyonu olan bir faktör kadar düşer.
Potasyum klorür çözeltilerinin heterojen çekirdeklenmesiyle ilgili deneysel
veriler, hem katalizlenmiş ve hem de katalist ilavesi olmadan çekirdeklenmeler
için ‘görünür’ yüzeyarası gerilim değerinin 2-3 erg/cm2 aralığında
olduğunu göstermiştir. Katalist ilavesi olmadığı durumda, mikroskopik aşılarla
self-katalizlenmiş ikincil bir çekirdeklenme gerçekleşiyorsa, aşılanmış KCl
çözeltisi için s değeri, 300 K
sıcaklıkta 2.8 erg/cm2 olacaktır. Görünür yüzeyarası gerilim sa ile gösterilerek, C = 1025
olarak alındığında, matematiksel yaklaştırmayla küçük (a -1) değerleri için lna
= a -1 = s kabul edilerek Denklem(10)
aşağıdaki şekilde yazılır.
B0 = 1025 eksp [- -¾¾¾¾¾¾¾] (11)
3(RT)3 v2 s2
Çözüm:
Problemi çözümünde Denklem(11) kullanılır. KCl’ün molekül ağırlığı 74.56,.
kristal yoğunluğu 1.988 g/cm3, disosiyasyonuyla K+ ve Cl-
iyonları oluşur; n = 2.
74.56
VM = -¾¾¾ = 37.51 cm3/g.mol sa = 2.5 erg/cm2
1.988
Denklem (11)’de eksponent:
16p
(37.51)2 x 6.0222 x 1023 x 2.53 0.03575
- -¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ = - ¾¾¾¾
3 (300 x 8.3143 x 107)3
(22 s2) s2
B0 = 1 için, s değeri:
0.03575/s2 = 57.565 s = (0.03575/57.565)1/2 = 0.02492
B0 = e57.565 e-0.03575/s2
Tablo-1
s |
B0 |
s |
B0 |
0.023 |
4.47 x 10-5 |
0.0255 |
13.3 |
0.024 |
1.11 x 10-2 |
0.027 |
5.04 x 103 |
0.02492 |
1 |
0.029 |
3.46 x 106 |
ÖRNEK-4:
0.029 süperdoygunlukta dengedeki bir çekirdeğin, örnek-3’deki koşullar
altında boyutu ne kadardır?
Çözüm:
Problem Kelvin eşitliğiyle çözülür. Burada a
= 1 + 0.029 = 1.029. Örnek-3’den VM, sa
, v, R, T değerleri ile Denklem (9)’dan,
4 x 37.51 x
2.5
ln 1.029 = -¾¾¾¾¾¾¾¾¾¾¾
2 x 8.3143 x 107 x
300L
L = 2.63 x 10-7 cm veya , 2.63 mm
İkincil Çekirdeklenme: Çekirdeklenme oluşumu, magmada makroskobik kristallerin bulunmasından etkilendiğinde ‘ikincil çekirdeklenme’ söz konusudur. İki tür ikincil çekirdeklenme olabilir. Bunlardan biri akışkan-shear (makaslama) etkisiyle meydana gelir. Diğeri mevcut kristallerin birbirlerine, veya kristalizör duvarları, pervaneler veya çalkalayıcı kollarına çarpmalarıyla ilgilidir.
Akışkan-Shear (Makaslama) Çekirdeklenme: Özel koşullar altında oluşan bir çekirdeklenme türüdür. Doygun çözelti, büyüyen bir kristalin yüzeyini geçecek şekilde uygun bir hızla hareket ettiğinde sınır tabakadaki shear gerilimler, embriyolar veya çekirdekleri süpürüp uzaklaştırır; aksi halde bunlar büyüyen kristalin içine girerek yeni kristaller oluşumuna neden olur. Böyle bir oluşum sakaroz kristalizasyonunda deneysel olarak saptanmıştır. Bu durum, MgSO4 7H2O’nın çekirdeklenmesinin incelenmesi aşamalarında da kanıtlanmıştır: Çalışmada çözelti, kristal yüzeyinde bir aşırıdoygunlukta shear etkisindeyken hemen daha yüksek bir aşırıdoygunluğa hızla soğutulmuş ve çekirdeklerin makroskobik boyutlara büyümesine izin verilmiştir.
Temas
Çekirdeklenme: İkincil çekirdeklenmenin, çalkalanma şiddetinden etkilendiği
uzun zamandan beri bilinmektedir; ancak, 1970’lere kadar bu etkinin yok
edilmesiyle ilgili deneysel veriler elde edilememiştir. Temas çekirdeklenme endüstriyel
kristalizörlerde en çok yapılan türdür, gerçekleşmesi için düşük aşırıdoygunlukta
çalışılır. Koşullar, iyi kaliteli kristallerin büyüme hızı için optimum seviyede
olmalıdır. Kristale çarpan enerji fevkalade düşüktür (birkaç yüz erg) ve
kristal yüzeyinde görünür bir etki yapmaz. Çekirdeklenme ve kristal büyümesi
alanlarında temas çekirdeklenmenin konumu Şekil-7’de noktalı hatlarla
gösterilmiştir.
Bu konuda yapılan çalışmalarda, çarpmada
darbe enerjisi bilinen küçük çubuklar ve akışkan aşırıdoygun bir çözeltide
konumlanmış bireysel kristallerin seçilmiş yüzeyleri kullanılmış, oluşan
çekirdeklerin sayısı ölçülmüştür: sayının, sadece aşırıdoygunluğa ve darbe
enerjisine bağlı olduğu görülmüştür. İnorganik kristaller için, her N temastaki
çekirdeklerin sayısı süperdoygunluk s ile, bazı organik kristaller için ln N, s
ile orantılıdır. Organik ve hidratlanmış inorganik kristaller için N sayısının
doğrudan temas enerjisi (E) aralığıyla orantılı olduğu görülmüştür; E, pratikte
önemli bir parametredir, fakat susuz inorganik kristaller için gerekli enerji,
diğer kristaller için olandan daha büyüktür ve çekirdeklenmeden önce bir eşik
enerjiye ihtiyaç vardır. Daha yüksek temas enerjileri için N sayısı
eksponensiyal E ile orantılıdır.
Peşpeşe yapılan temas denemeleri aynı
çekirdeklenmeyi veriyorsa, temasların genellikle birkaç saniye aralıkla
yapılması uygun bir yöntermdir.
Temas çekirdeklenme, büyüyen kristalin yüzeyi
üzerinde mikroskopik dendritik oluşumların (büyümelerin) kırılmalarının ve
kristal içinde organize olmak için hareket eden solut partikülleri clusterlerle
temas eden objelerin arayüzünün bir kombinasyonu olabilir. Temas eden objelerin
hareketinin, embriyolardan-L’den çok daha büyük küçük kristallere kadar olan
boyuttaki partikülleri saptırıp çıkardığı varsayılıyor; yani, aşırıdoygun
çözeltiyle dengede bulunan bir kristalin maksimum boyutu Kelvin eşitliğinde
verildiği gibidir (Denklem-9). En az L kadar büyüklükteki partiküller
yaşayabilir ve yeni çekirdekler olarak büyürken, daha küçükler çözünür.
Kristal Büyümesi
Kristal büyüme, büyümenin meydana geldiği katı yüzeylerin etkisiyle yönlendirilen bir difüzyon prosesidir. Solut moleküller veya iyonlar, sıvı faz boyunca difüzyon yoluyla bir kristalin büyüyen yüzeylerine ulaşır. Bu aşamaya klasik kütle-transfer katsayısı uygulanır. Yüzeye gelen moleküller ve iyonlar kristal tarafından kabul edilmeli ve uzamsal latiste organize edilmelidir. Yüzeyde sınırlı bir hızla meydana gelen reaksiyonla tüm proses iki kademede tamamlanır. Çözelti aşırıdoygun olmadıkça difüzyonal ve yüzeyarası kademeler gerçekleşemez.
Bireysel
ve Tüm Büyüme Katsayıları: Kütle transferi operasyonlarında fazlar
arasındaki arayüzde denge olduğu kabul edilir. Kristalizasyonda böyle bir koşulda,
kristalin yüzeyinde çözeltinin konsantrasyonu doygunluk değerindedir (ys);
kütle transferi için toplam yürütücü kuvvet y – ys olacaktır (y,
kristal yüzeyinden belli bir mesafedeki konsantrasyonur). Yüzey reaksiyonu
nedeniyle, arayüzey kademesi için bir yürütücü kuvvete gerek vardır: arayüzeki
konsantrasyon y’ ile gösteriliyor; ys < y’ < y. Kütle
transferi için yürütücü kuvvet y –y’ (Şekil-8).
Kütle transferi ve yüzey reaksiyonu
katsayıları bir kristal yüzeyinden diğer bir kristale değişir, fakat tüm
kristal için sadece ortalama değerler dikkate alınabilir.
Bu bakış açısıyla kütle transferi eşitliği,
NA = ¾ = ky (y – y’) (12)
sp
m. = kütle transfer hızı, mol/saat
sp = kristalin yüzey alanı
ky = kütle transfer katsayısı
Yüzey reaksiyonu için ks
değeri kullanılır ve tüm katsayı K eşitliği çıkarılır::
¾ = ky (y’ – ys) (13)
sp
K º ¾¾¾¾¾ (14)
sp (y – ys)
K º ¾¾¾¾¾¾ (15)
1/ky – 1/ks)
Büyüme
Hızı: Değişmeyen (invaryant) bir kristal için kristalin hacmi (vp).
karakteristik uzunluğunun (L) küpü ile orantılıdır.
vp = a L3 (16)
a bir
sabittir. rM molar yoğunluk
ise, kristalin kütlesi m:
m = vp rM = a L3 rM (17)
Denklem (17) zamana göre.
dm dL
m. = ¾¾ = 3 a
L2 rM (¾¾) (18)
dt dt
Büyüme hızı dL/dt, G ile gösterilir. Aşağıda
görülen Denklem 2’den,
6 vp
L = Fs Dp ¾¾
sp
sp = 6 vp/L
= 6 a L2
Denklem (18)
ve (14) kullanılarak, Denklem (19) ve bundan da (19) elde edilir.
3 a L2 rM
G
K = ¾¾¾¾¾¾¾ (19)
6 a L2 (y - ys)
2 K (y – ys)
G = ¾¾¾¾¾¾ (20)
rM
Kütle-Transfer
Katsayıları: Şekil faktörü 1.0’a yakın kristaller veya küreler için kütle
transfer katsayısı ky’yi tahmin etmek için,
NSh = 2.0 +
0.6 NRe1/2 NSc1/3
Eşitliği kullanılabilir. Çalkalanan bir
sistemde süspansiyon haldeki partiküller için kütle-transfer katsayısı,
kristallerin uç ayar hızından hesaplanan değerin 1.5-5 katı kadardır.
Yüzey-Büyüme
Katsayıları: Yüzeyarası reaksiyonla kristallerin büyümesiyle ilgili pek çok
araştırma yapılmış ve standart monograflar yayınlanmıştır. Kristal büyümesiyle
uyumlu bir teori geliştirilmiş olmasına rağmen dizaynda kullanılan, ks
hakkındaki sayısal veriler azdır.
Bir teori, büyümenin kristal yüzeyinde
tabaka-tabaka oluştuğu kavramına dayanır; her yeni tabaka yüzeye eklenen iki
boyutlu bir çekirdek gibi başlar. Bu teori büyümenin, uygun bir eşik
süperdoygunluğa ulaşılıncaya kadar başlamayacağını ve süperdoygunlukta büyüme
hızının hızla artacağını ve doğrusal (lineer) olacağını kabul eder. Gerçekte,
pek çok kristalin büyüme hızı süperdoygunlukla lineerdir, bir eşik değerinin
olması zorunluluğu yoktur.
Gözlenen ve teorik büyüme hızları arasındaki
fark, Frank vida (screw)-çıkığı (dislokasyon) teorisiyle ilişkilendirilmiştir.
Hakiki kristallerin gerçek uzam latisleri mükemmel değildir ve böyle kusurlu
kristallere ‘dislokasyonlar’ denir; bunlarda yüzeylerde ve kristal içindeki
partiküllerin düzlemleri yer değiştirir. Birkaç çeşit dislokasyon vardır. Çok
bilinen bir dislokasyon vida-dislokasyondur (Şekil-9’da bireysel partiküller
kübik yapı blokları olarak gösterilmiştir). Bir shear düzlemdeki dislokasyon
kridtsl yüzeyine paraleldir ve kristalin kaymasıyla bir rampa meydana gelir.
Rampanın kenarı iki-boyutlu bir çekirdek gibi davranarak içinde partiküllerin kolayca
yerleşebileceği bir kıvrıntı hazırlar. Tam bir yüzey asla oluşmaz ve çekirdeklenme
yoktur. Büyüme devam ederken rampanın kenarı spirale dönüşür, kenar boyunca
devam eden partikül çökelmesi kristal büyüme mekanızmasını oluşturur. Böyle bir
mekanizma ileri sürüldüğünden pek çok vida dislokasyon örnekleri, elektron
Mikroskopisi ve diğer yüksek ileri teknoloji araçlarıyla incelenmiş ve gerçekliği
gözlenmiştir.
G ¹ f(L)
uygulandığında,
Magmadaki her kristalin, aynı zaman aralığında (Dt) toplam büyümesi aynıdır.
DL = G Dt (21)
Ticari kristalizörlerde ya sürekli (komtinü)
veya yığın (batchwise) yöntemi kullanılabilir. Özel uygulamalar dışında sürekli
yöntem yercik edilir. herhangi bir kristalizör için ilk gereksinim süperdoygun
bir çözeltinin oluşturulmasıdır; çünkü, süperdoygunluk olmadan kristalizasyon
oluşamaz. Süperdoygunluğun (aşırıdoygun) sağlanabilmesi için, solutun
çözünürlük eğrisinin yapısına bağlı olarak uygulanan üç metot vardır:
1. Potasyum nitrat ve sodyum sülfit gibi
solutlar düşük sıcaklıklarda, yüksek sıcaklıklara göre çok daha az çözünürler;
bu nedenle soğutmayla süperdoygunluk kolaylıkla sağlanabilir.
2. Çözünürlüğün sıcaklığa hemen hemen bağlı
olmadığı -sıradan tuzlar gibi- veya sıcaklığın artmasıyla azaldığı durumlarda
süperdoygunluk buharlaştırmayla yaratılır.
Kristalizörlerdeki
Değişiklikler: Ticari kristalizörler, çeşitli yöntemlerle farklılaştırılabilir.
Önemli bir farklılık, kristallerin süperdoygun sıvıyla nasıl temas ettirileceği
ile ilgilidir.
Birinci teknikte süperdoygun bir çözelti
akımı, büyüyen kristallerin akışkan yatağından geçirilir, süperdoygunluk
çekirdeklenme ve büyümeyle harcanır; bu yöntem ‘sirkülasyon-sıvı metot’ olarak
adlandırılır. Doygun sıvı sonra bir soğutma veya buharlaştırma bölgesine
pompalanır, burada tekrar süperdoygun hale getirilir ve son olarak da
kristalizasyon bölgesinde resaykıla (geridönüşüme) alınır.
İkinci teknik, ‘sirkülasyon-magma metodu’dur.
Bu yöntemde magmanın tümü, sıvı katıdan ayrılmaksızın, hem kristalizasyon ve
hem de süperdoygunluk aşamalarında sirküle edilir. Mevcut kristallerde,
kristalizasyon ve süperdoygunluk metdana gelir.
Her iki metotta da, kristallenme ve
süperdoygunluk bölgeleri arası sirkülasyon akımına besleme çözeltisi ilave
edilir.
Kristalizörlerin bir tipinde
boyut-sınıflandırma cihazları kullanılır; bu cihazlar büyüme bölgesinde, daha
fazla büyüyebilmesi için küçük kristallerin kalmasına, ürün olarak sadece
belirtilen minimum boyutlardaki kristallerin geçmesine izin verecek şekilde
dizayn edilir. İdeal hal, böyle bir kristalizörün ‘tek uniform boyutta’ sınıflandırılan
bir ürün vermesidir. Diğer kristalizörler, kristallenme bölgesinde tamamen
karıştırılan-süspansiyonlar bulunacak şekilde dizayn edilir; çekirdekten-büyük
kristallere kadar tüm boyuttaki kristaller muntazam olarak magma boyunca dağılmıştır.
İdeal olanı, bir karıştırma süspansiyon ünitesinden alınan üründe boyut
dağılımının magmadaki kristallenmeye eşdeğer olmasıdır.
Bir karıştırılan-süspansiyon ünitesinden
alınandan daha büyük boyutta ortalama kristal boyutu elde edebilmek için, bazı
kristalizörlerde, kristalizasyon bölgesinden ince kristallerin çoğunu ayırıp
uzaklaştıran cihazlar bulunur. Bu küçük kristaller tekrar çözülür ve
kristalizöre gönderilir. Diğer bir tip kristalizörlerde iki ‘take-off
(çıkarma)’ hattı bulunur; bunlardan biri büyük kristaller, diğeri küçükler
içindir. Hacimleri oldukça farklı iki ürün akımı birleştirilir ve bir filtreye
veya ayırma ünitesine verilir.
Vakum
Kristalizörler: Vakum üniteleri sınıfındaki en modern kristalizörlerdir;
bunlarda süperdoygunluk yaratılması, adyabatik buharlaştırmayla sağlanır. Orijinal
ve en basit formunda böyle bir kristalizör vakum altında kapalı bir kaptır, kristalizör
ve bir kondenser arasına konulan bir buhar-jet vakum pompasıyla sürekli bir
vakum sağlanır. Sisteme (kap), kristalizörün basıncında, kaynama noktasının
üzerindeki bir sıcaklıkta (genellikle ılık olur) doygun bir çözelti beslenir.
Magma hacmi, kaptaki kristallenen katı ve sıvı seviyesi tarafından kontrol
edilir; magmanın üstündeki boşluk buharın çıkarılması ve sürüklenenlerin
giderilmesinde kullanılır. Besleme çözelti denge sıcaklığına kendiliğinden
soğur. Çünkü hem soğuma entalpisi ve hem de kristalizasyon entalpisi,
buharlaşma entalpisi haline dönüşür; solventin bir kısmı buharlaşır. Soğuma ve
buharlaşmayla oluşan süperdoygunluk çekirdeklenme ve büyümeyi sağlar. Magma
ürünü kristalizörün dibinden çekilir. Kristallerin teorik verimi, denge
sıcaklığında solutun çözünürlüğü ve beslemenin konsantrasyonu arasındaki farkla
orantılıdır. Şekil-10’da, yardımcı ünitelerin, magma ürün ünütesi ve işlenmesinin
de yer aldığı bir sürekli vakum kristalizörün şematik görünümü verilmiştir.
Draft tüp-bafıl kristalizörlerde, kristalleri
boyutlarına göre sınıflandırma ve inceleri ayırma amaçlı bir elutriasyon
(yıkayıcı) bacak bulunur (Şekil-12). Sirkülasyondaki sıvının bir kısmı bacağın
altına pompalanır ; küçük kristalleri, daha fazla büyüyebilmeleri için tekrar
kristalizasyon bölgesine taşır.
ÖRNEK-5:
sürekli çalışan bir vakum kristalizöre %31’lik MgSO4 çözeltisi beslenmektedir.
Kristalizörde magmanın denge sıcaklığı 86 0F (30 0C) ve çözeltinin
kaynama noktası yükselmesi 2 0F (1.11 0C)’dir. Saatte 5
ton (4536 kg) MgSO4 7H2O magma ürün elde edilmektedir.
Katının magmaya hacim oranı 0.15, kristallerin ve ana sıvının yoğunlukları 105
ve 82.5 lb/ft3’tür. Beslemenin sıcaklığı, besleme hızı ve buharlaşma
hızı nedir?
Çözüm:
Problemin grafiksel çözümü Şekil-13’te gösterilmiştir.
a noktasının
koordinatları: H = 1098 Btu/lb c = 0
Ürün magmanın ortalama konsantrasyonu ve
entalpisi Şekil-4’deki verilerden hesaplanır. fd hattı, Şekil-4’deki bcih
alanındaki 86 0F izotermidir. Uçların koordinatları,
d noktasının koordinatları: H = -149 Btu/lb c = 0.488
Kristallerin ana sıvıya kütle oranı:
Üretilen toplam magma: 10 000 + 44520 = 54520 lb/saat
Magmadaki ortalama MgSO4
konsantrasyonu:
¾¾¾¾¾¾¾¾¾¾¾¾ = 0.322
Magmanın entalpisi:
¾¾¾¾¾¾¾¾¾¾¾ = - 62.4 Btu/lb
Bunlar e noktasının koordinatlarıdır. Besleme
noktası ae hattı üzerinde olmalıdır. Besleme konsantrasyonu 0.31 olduğundan,
beslemenin entalpisi b noktasının ordinatı veya -21 Btu/lb’dir. b noktası 130 0F
(94.4 0C) izotermi üzerindedir ve dolayısıyla bu sıcaklık besleme
sıcaklığıdır.
Merkez-gravite prensibine göre buharlaşma
hızı,
54520 ¾¾¾¾¾¾¾ = 2017 lb/saat (915 kg/saat)
Toplam besleme hızı:
54520 + 2017 = 56537 lb/saat (25645 kg/saat)
4.
ERGİYİKLERDEN (MELT) KRİSTALİZASYON
Bazı organik bileşiklerin yapılmasında son
aşama ürünün, saflaştırılmış bir ergiyik akımdan katılaştırılmasıdır. Bu işlem
genellikle, dondurularak (drum flakerde) veya soğutularak (titreşimli
konveyörde) veya çalkalanarak (ceketli çalkalama kabında) yapılır. Bazen sıvı
dondurmadan 20-50 0C kadar soğutulabilir ve mekanik çalkalama veya
aşılamayla kristalizasyon başlatılabilir.
İkili veya üçlü organik karışımlar, özellikle
aromatik izomerler basit soğutmalarla saflaştırılabilir. Katı çözeltiler
oluşmadıkça çoğu zaman, bir izomerin gerçek saf kristalleri üretilebilir.
Örneğin, ksilen izomerlerin karışımı iki-kademeli bir kristalizasyon sisteminde
-60 0C’de işlemlendiğinde p-ksilen kristaller ayrılır; ilk oluşan
kristaller yeteri kadar saf değildir, ergitilir ve yeniden kristallendirilir.
İkinci ürün toluen veya başka uygun bir solventle yıkanarak yapışmış olan ana
sıvı uzaklaştırılır.
Diğer işleme sistemlerinde saf ürün
ergitilir, bir kısmı, kristallerin yıkanması ve saflaştırılması için refluks
edilir. Böyle tipe bir örnek olarak, Şekil-14’te görülen ‘Brodie Saflaştırıcı’
gösterilebilir. Sistemde, yerleştirilmiş birkaç pürüzlü-yüzeyli soğutucu serisi
ve saflaştırma kolonunu bulunur. Ergimiş besleme son suğutucunun ortasından
girer. Sıvı, sistemin sıcaklığın en düşük olduğu kalıntı uçuna doğru akar.
Kristaller konveyörler tarafından ürün tarafına taşınır, dikey saflaştırma
kolonuna boşaltılır. Kolonun tabanında ergitilen kristallerin bir kısmı ürün
olarak çekilir, bir kısmı da kolonun üstünden refluks edilir. Refluks, kristal
yüzeylerini yıkar, kalıntıları temizler, ergime noktalarına getirir. Bu
yöntemle klorobenzen izomerlerden % 99.9 saflıkta p-diklorobenzen elde
edilmiştir.
9 Şubat 2021
GERİ (proje çalışmaları)