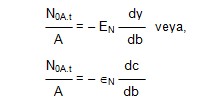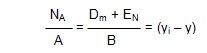Difüzyon, fiziksel bir uyarımla bir bileşenin
bir karışım içindeki hareketidir. En önemli parametre, difüzlenen bileşenin
konsantrasyon değişikliğidir. Konsantrasyon dalgalanması bileşeni, bu
farklılığı bozacak ve eşit konsantrasyona ulaşmasını sağlayacak yönde hareket
etme eğilimine sokar. Dalgalanma bozulmaz ve sabit bir halde devam ederse,
difüzlenen bileşen akımı sürekli olur. Örneğin, su akımı ile temasta bulunan
bir tuz kristalinin, yüzeyi yakınında bir konsantrasyon dalgalanması doğar;
tuz, yüzeye dik bir yönde sıvı tabakaları arasına difüzlenir. Yüzeyden tuz
ayrılması, kristal tamamen çözününceye kadar devam eder.
Basınç veya sıcaklık dalgalanmaları da difüzyona yol açan
parametrelerdir. Burada konsantrasyon dalgalanmasının neden olduğu difüzyon
üzerinde durulacaktır.
Kütle
Transferinde Difüzyonun Rolü
Tüm kütle-transferi işlemlerinde en az bir fazda, çoğu zaman
her iki fazda birden difüzyon meydana gelir.
Gaz absorbsiyonunda madde önce gaz fazdan geçerek fazlar
arasındaki arayüzeye ve arayüzeyden de sıvı faza difüzlenir.
Distilasyon işleminde, zenginleştirme bölgesinde düşük
kaynayan bileşen sıvı fazdan geçerek arayüzeye difüzlenir ve arayüzeyden buhara
geçer. Yüksek kaynayan bileşen ters yönde hareket eder; buhardan sıvıya geçer.
Katı ekstraksiyonunda madde, faz arasından geçerek sıvıya
girer. Sıvı ekstraksiyonunda rafinat fazından gelen madde önce arayüzeye, oradan
ekstrakt fazına difüzlenir.
Kristalizasyon işleminde, ana sıvıdan kristallere madde
difüzyonu olur; madde katı yüzey üzerinde toplanır.
Nemlendirmede sıvı fazdan difüzyon yoktur, çünkü sıvı faz
saftır ve herhangi bir konsantrasyon dalgalanması olmaz; fakat sıvı-gaz yüzeye
(veya yüzeyden), oradan da gaz faza (veya gaz fazdan) buhar difüzyonu vardır.
Kurutmada, sıvı haldeki su, katının içinden yüzeyine
difüzlenir, buharlaşır ve sonra buhar olarak gaza difüzlenir.
DİFÜZYON
TEORİSİ
Burada difüzyonun nicel ilişkileri incelenmiş, ekipman
içindeki belirli bir yerde ve fazlar arasındaki yüzeye göre dikey bir yöndeki
difüzyon dikkate alınmıştır. Durgun hal varsayılmıştır ve herhangi bir
noktadaki konsantrasyonun zamanla değişmediği öngörülmüştür.
Difüzyon
ve Isı Transferinin Kıyaslanması
Isı akışı ve difüzyon arasında bir benzerlik vardır. Isı
transferinde yürütücü kuvvet sıcaklık dalgalanması, difüzyonda ise konsantrasyon
dalgalanmasıdır. İki durumda da akı, dalgalanmayla doğru orantılıdır. Ancak ısı
bir madde değildir, bir enerji şeklidir; bu nedenle daha ileri bir benzerlik
düşünülemez. Isı bir noktadan bir diğerine akarken arkasında bir boşluk
bırakmadığı gibi, ulaştığı noktada bir yer işgal etmez. Isının hızı diye bir
kavram yoktur. Oysa difüzyon maddenin fiziksel olarak akmasıdır ve belirli bir
hızla gerçekleşir. Difüzlenen bileşik arkasında bir boşluk bırakır ve geldiği
yerde bir hacim kaplar.
Madde akışı olan difüzyon, ısı transferinde bulunmayan üç
yeni sorunu karşımıza çıkarır:
1. Tüm bileşenlerin bir faz içerisinde olduğu düşünülmelidir.
İki bileşenli bir karışımda hem A hem de B bileşenleri göz önüne alınır.
Difüzyonun yönünde tüm fazın net bir akışı söz konusu olabilir. Bu net akış her
bir bileşen akımının cebirsel toplamına eşittir.
2. Eğer arayüzeye dik olan tüm fazın net akışı sıfırdan
farklı ise fazın kütlesi yükselir veya düşer; arafazın kütlesi tüm fazların
kütlesinin toplamını sabit tutmak üzere değişir.
3. Madde bir hareket içerinde olduğundan, akımlar ve hızlar,
kalanın değişken haline göre görecelidir.
Eşmolal
(Equimolal) Difüzyon; Hareketsiz Fazın Hacmi
Sabit duran bir gözlemciye göre tüm fazda net bir hareketin
olmadığını halde, gözlemciye göre herhangi bir yönde net bir molal akış söz
konusu değildir. Tüm A moleküllerinin kırmızıya ve tüm B moleküllerinin maviye
boyandığını ve geçmeye başladıkça sayılabildiğini farz edelim. Kırmızı
moleküllerin sağa ve mavi moleküllerin sola doğru hareketleri söz konusu olsun.
Eğer gözlemci kırmızı moleküllere eşit sayıda mavi moleküllerin geçtiğini
görüyorsa, bu durum moleküllerin net bir akışının olmadığını gösterir. Burada
kütleler değil moller göz önüne alınmıştır. Net molal akışın sıfır olduğu
durumda eğer kırmızı moleküller mavilerden daha ağırsa (yüksek molekül
ağırlığı) net kütle akışı sağa doğru dur.
Moleküler
Difüzyon; Fick Kanunu
Difüzyon olayı sadece moleküler hareketten doğar; ısı-transferi
işlemindeki kondüksiyonla iletimde olduğu gibi. Difüzyon, moleküler ve
türbülent hareketin birleşmesiyle olabilir; bu durum kondüksiyon-konveksiyonla
ısı iletimine benzer. Sadece moleküler difüzyon olduğu, türbülent hareketin
bulunmadığı durumda, A bileşeninin difüzyon hızı aşağıdaki denklemle verilir. Bu
eşitliğe Fick Kanunu denir; ısı transferinde görülmüş olan Fourier Kanununun
bir benzeridir.
DmA = A bileşenin "molal difüzlenebilmesi";
N = molal akış hızı; N0A / A = molal akı (ısı transfer akısı q/A ya
benzer); dyA/db = konsantrasyon dalgalanması (sıcaklık dalgalanması
dT/db ye benzer); b = difüzyon yönünde faz sınırından olan uzaklık; A = kütle
transferine dik yöndeki alandır.
B bileşeni için,
Moleküler difüzyon ısı transferi ile karşılaştırıldığında, N0A/A
ve N0B/B nin molal akışları, ısı transferindeki akış q/A ya, difüzyon
Dm termal iletkenlik k ya, ve konsantrasyon değişimleri dyA/db
ve dyB/db, ısı değişimi dT/db ve benzerdir.
Tüm fazın kararlı olduğu iki-bileşenli bir sistem için,
Aynı molal difüzivite, iki bileşenli bir karışımın her iki
bileşenine de uygulanabilir ve Dm her bir bileşen için de
kullanılabilir.
Molal
Difüzivite Dm (kg mol m-1 s-1)
Yayılma güçlerine kinetik gaz ve sıvı teorilerinde daha çok
yer verilmiştir. Gazların bu özellikleriyle ilgili olarak yapılan çalışmalar,
gazlar içindeki difüzyonun kinetik teorisinin daha iyi anlaşılmasını
sağlamıştır.
Gazlar
İçinde Difüzyon
Moleküler gaz difüzyonu moleküllerin lineer hareketinden
kaynaklanırr. Herhangi bir anda gaz içindeki her bir molekül sıfırdan çok
yüksek değerlere doğru değişen hızlarda rasgele yönlere hareket ederler.
Verilen bir sıcaklık ve basınçta, ortalama hız sabit olup ~1000 ft/saniye kadardır.
Bu kadar yüksek hızlar, konsantrasyonların moleküler difüzyonla hızlı bir
şekilde eşitlendiği anlamına gelir. Geniş moleküler dağılımdan dolayı (1atm ve
32 ºF de yaklaşık 7.6x1023 molekül/ft3) çarpışmalar o
kadar sıklaşır ki, her molekülün yolu peşpeşe kesilir ve hızında çoğu zaman
birim saniyede gerçekleşen büyüklük ve yön değişmeleri olur. Bu nedenle, 1atm
ve 32 ºF da azot gazı moleküllerinin ortalama hızı 1490ft/saniye olmasına rağmen,
her bir molekül her saniyede ortalama 5x1011 kez gerçekleşen
çarpışma yapar, ve konsantrasyon değişimi altındaki yığın hareketinin sonucunda
etkili hızı küçük olur.
Küçük moleküller büyük moleküllere göre daha büyük ortalama
hızlara ve düşük çarpışma sayılarına sahiptirler. Sıcaklık ne kadar yüksek
olursa, ortalama hız o kadar büyük olur. Difüzyon sıcaklığın artmasıyla artar, molekül
ağırlığı ve molekül boyutlarının artmasıyla azalır. Havada bulunan gazların difüziviteleri
EK-17’de verilmiştir.
Difüzivetelerin
Bulunması
Bir gaz içindeki difüzyon kinetik teoriden hassas bir
şekilde tahmin edilebilir. Aşağıdaki uygulama yaklaşım metodunu göstermektedir.
Aynı çap (d), ve kütlede (m) olan, n molekül içeren 1ft3 bir gazdaki
moleküllerin ortalama lineer hızları aşağıdaki denklemle verilir:
u = ortalama doğrusal hız, ft/saniye; k = Boltzmann sabiti, 5.65x1024f t-lbf/ºR;
T = mutlak sıcaklık, ºR; m = tek
molekülün kütlesi, lb
Moleküller için ortalama serbest yol,
l = ortalama serbest
yol, ft; d = molekül çapı, ft; n = her ft3 deki molekül sayısı
Şekil-1 de görüldüğü gibi bir gaz hacmi içerisinde AA gibi
hayali düz bir düzlem olduğunu düşünelim. Gaz A ve B gibi iki bileşen
içermektedir; düzlemde yer alan A nın mol kesri y dir. Moleküller düzleme her
iki yüzünden yaklaşır ve içerisinden geçerek tüm yönlere doğru difüzlenir
(yayılır).
Şekil-1: A taneciklerinin,
birbirinden a uzaklığında bulunan düzlemlerde çarpıştıktan sanra a düzlemine
moleküler taşınması
Eğer moleküller düzlemden ortalama serbest yoldan büyük
olamayacak bir uzaklıkta hareketlerine başlarlarsa, düzleme dik olarak hareket
eden moleküller diğer moleküllerle çarpışmadan varışlarını gerçekleştirir.
Düzleme diğer yönlerden yaklaşan moleküllerin diğer moleküllerle çarpışmadan
düzleme ulaşmalrı bekleniyorsa, bunlar, λ dan daha az dikey uzaklıklardan
başlamak zorundadır. Ortalama olarak, AA düzlemiyle çarpışmadan düzleme ulaşacak
moleküllerin orijin noktaları arasındaki uzaklık olan a, ⅔λ a eşittir. Orijinin
bu uzaklığına uyan BB ve CC düzlemleri Şekil-1 de gösterilmektedir; bu yerlerde
A nın mol kesirleri sırasıyla y(-a) ve y(+a) dır. Şekilde
görüldüğü gibi, y nin 2a’ya kadar olan değişiminin sabit olduğu
varsayılmaktadır.
BB düzleminden AA düzlemine doğru AA düzleminden yukarıya
geçen moleküllerin sayısı duvar çarpışma sıklığı denilen Z(-a)
eşitliği ile verilir.
Burada Z(-a) toplam AA düzleminin her ft2
'sinden birim saniyede yukarıya geçen moleküllerin sayısı olup, yukarı doğru
akışı bildirir. Toplam akışın A molekülerinden oluşan kısmı,
Benzer şekilde AA düzleminden aşağıya doğru gelen, CC
düzleminden geçen A moleküllerinin moleküler akışı,
AA düzleminden geçen A nın net moleküler akışı z(-a)
ve z(+a) arasındaki farka eşittir. Birim saatteki lb mol cinsinden,
Burada Na Avagadro sayısıdır (bir lb mol içindeki
moleküllerin sayısı). Denklem (2) ve (3) deki yer değiştirmelerden,
BB ve CC düzlemleri arasındaki konsantrasyon değişimi lineer
kabul edildiğindan, denklem aşağıdaki gibi verilir.
Denklem (5) y(-a) – y(+a) için
çözülürken Denklem(4) ile gerekli yer değiştirmeler yapıldığında,
a = 2l/3 olduğundan,
Bu denklem,
Fick Kanunu eşitliğiyle kıyaslandığında,
Eğer A ve B bileşenlerinin molekülleri çap ve kütle olarak
benzer ise, difüzyon, aşağıdaki moleküllerin ortalama lineer hız denklemleri,
dikkate alınarak çıkarılabilir:
İdeal gazlar için ρM = p/R0T ve n = p/kT dir. Dm(AA) kısmi difüzyon katsayısıdır. A ve B molekülleri farklı çap ve kütlelere sahipse, difüzyon aşağıdaki denklemle verilir; dAB= (dA+ dB)/2 dir.
Şekil-2: Difüzyonda çarpışma
fonksiyonu
Denklem (6), normal şartlardaki difüzyonları hesaplamak için
kullanılır. Özellikle yüksek sıcaklıklarda daha uygun veriler elde etmek için,
A nın ve B nin bir molekülü arasındaki moleküller arası potansiyel etkileşimi
göz önüne almak gereklidir. Chapman-Enskog kinetik teorisinden elde edilen en
uygun denklem,
Burada T= mutlak sıcaklık, ºR; MA, MB = A ve B nin molekül ağırlıkları; rAB = çarpışmadaki moleküler ayrılma, A0; rAB = (rA + rB)/2; W = çarpışma fonksiyonu, kT/ЄAB nin bir fonksiyonu; ÎAB = moleküler etkileşim enerjisi, ft-lbf ‘dir.
Çeşitli gazlar için çarpışma fonksiyonu Ω (Şekil-2) için r ve Є/k değerleri Tablo-1 de verilmiştir. Deneysel verilerin yokluğunda bu değerler, aşağıdaki denklemlerden hesaplanabilir.
Burada T= mutlak sıcaklık, ºR; MA, MB = A ve B nin molekül ağırlıkları; rAB = çarpışmadaki moleküler ayrılma, A0; rAB = (rA + rB)/2; W = çarpışma fonksiyonu, kT/ЄAB nin bir fonksiyonu; ÎAB = moleküler etkileşim enerjisi, ft-lbf ‘dir.
Çeşitli gazlar için çarpışma fonksiyonu Ω (Şekil-2) için r ve Є/k değerleri Tablo-1 de verilmiştir. Deneysel verilerin yokluğunda bu değerler, aşağıdaki denklemlerden hesaplanabilir.
Sıvılarda Difüzyon
Sıvılar içindeki difüzyon teorisi, gaz difüzyonunda olduğu
kadar ne yeterince geliştirilmiş ne de deneysel veriler yeterince uygundur.
Sıvılar içindeki difüzivete, gazların içindekinden daha küçüktür. Sıvı
difüzyonu, moleküler hızlardan ziyade moleküllerin birbirlerini çekme
fonksiyonu olan ve sıvı içindeki molekülleri hareket ettirmek için gerekli olan
enerjiye dayanır. Sıvılar içindeki difüzyon, konsantrasyonla yaklaşık olarak
lineer değişme gösterir.
Sıvılar için difüzyon aşağıdaki eşitlikten hesaplanabilir.
ρM=çözeltinin molal yoğunluğu, lb mol/ft3;
μ = çözeltinin viskozitesi, lb/ft-saat; VA=normal kaynama noktasında
çözünen sıvının molal hacmi, ft3/ lb mol; k1 = çözücü
için birleşme parametresi
k1 su için 2.6, metanol için 1.9, etanol için
1.5, ve benzen, heptan, eter ve diğer bazı çözücüler için 1.0 dır. Denklem (8)
elektrolitlere uygulanmaz ve sadece düşük konsantrasyonlarda geçerlidir.
Hacimsel
Difüzivite, Dv
Gaz ve sıvı difüziviteleri için, Denklem (7) ve (8) yerine,
yeterli ise deneysel veriler kullanılmalıdır. Bu tür veriler, fiziksel ve
kimyasal verilerin standart tablolarında bulunabilir. Genellikle veriler, molal
difüzivite Dm olarak değil, hacimsel difüzivite Dv olarak
verilmektedir. Bu değerler Dm ye aşağıdaki denklemle ilişkilidir.
ρM karışımın molal yoğunluğudur. İdeal gazlar ve
sıvılar için, ρM konsantrasyondan bağımsızdır, DvA = DvB.
Eğer ρM ideal olmayan gazlar ve sıvılarda olduğu gibi
konsantrasyonla değişirse, DmA ve DmB eşit olmaya devam
ederken DvA ve DvB eşit olmazlar. Ayrıca, Dv
basınçla ters olarak değişirken Dm basınçtan bağımsızdır).
Elde edilen Dv nin boyutları L2 t-1
dır. Tipik değerler Ek 17 de
verilmiştir. Termal difüzivite α, aynı boyutlara sahiptir. Dv için
kullanılan genel literatür birimleri birim saniyede santimetre karedir. Birim
saniyede santimetrekareyi birim saatte ft kareye çevirmek için, 3,600/30.482
= 3.875 ile çarpmak gerekir. Sıvılarda Dv değerleri genellikle seyreltik
çözeltilere uygulanır.
ÖRNEK
10 atm ve 200 ºF daki florotriklorometan-azot sistemi için
molal difüziviteyi Dm, lb mol/ft-saat ve volumetrik difüziviteyi (Dv)
ft2/saat olarak hesaplayınız. (FCCl3 ün kritik
özellikleri: Tc = 388.4ºF, ρc = 3.44 lb/ft3,
azot için, rB = 3.681 A0, ÎB/k = 164.6 ºR; çarpışma
fonksiyonu W = 1.04)
Çözüm:
Çözümde aşağıdaki denklem kullanılacaktır.
T = 660 ºR, MA = 137.5, MB = 28, Vc
= 137.5 / 3.44 = 4.00 ft3/lb mol, Vc = kritik hacim, rB
= 3.681 A0 (veriliyor)
Hareket Halindeki Faz Yığınıyla (bulk)
Difüzyon
Önceki paragraflarda, eşmolal olan birbirine zıt olan iki
akım halindeki A ve B de olduğu gibi net bir akışın olmadığı şartlardaki
difüzyonun oluşumundan bahsedilmişti. Çoğu difüzyon işlemlerinde difüzyon
doğrultusu içinde tüm fazların net bir akışı vardır. Bu akış difüzyondan
bağımsız olarak maddeyi bir yerden bir diğerine hareket ettirir. Bu şartlar
altındaki yığın hareketi yönünde difüzlenen A bileşeni kendi difüzyon hızı
yığınınkine eklendiğinden, sabit bir gözlemciye göre faz yığınından daha hızlı
hareket ediyor gibi görünür. Zıt yönde difüzlenen B bileşeni ise yığından daha
yavaş hareket ediyor veya duruyor gibi görünebilir.
Difüzyon
Hızları
Akış ve hız arasındaki ilişkinin iki temede sentezlenmesi
istenir: (1) durgun bir arayüze göre ve (2) bir bütün olarak faza göre. Şekil-3a’da
görüldüğü gibi iki bileşenli akışkan bir faz içindeki bir bölümü düşünelim. MM,
A ve bileşenlerinin difüzlendiği arayüzü temsil etsin. Arayüzün alanı A, ft2
‘dir. Hızların arayüze göre göreceli olduğunu varsayalıyor. Arayüzden faza
geçen A ve B bileşenlerinin akımı sırasıyla NA/A ve NB/A
lb.mol/ft2-saattir. Akışın durgun olmasından dolayı NA/A
ve NB/A, arayüzeye paralel diğer düzlemlerden geçen akımlar olup
arayüzeyden sabit bir uzaklığa sahiptir. MM den b ft uzaklıkta yer alan db
kalınlığındaki bir dilim içerisindeki A ve B bileşenlerinin konsantrasyonları, cA
ve cB lb,mol/ft3 dir. Difüzyon devam ettiğinden cA
ve cB b ile değişim gösterir,
NA/A ve NB/A akımları sabittir.
Şekil-3a’da temel dilimin hacmi A db ft3 tür.
Dilimdeki A bileşeninin miktarı AcA db lb mol’dür. Bu bileşenin akış
hızı NA mol/saat olduğundan dilimin içinden geçiş zamanı AcA
db/NA saat olur. Bu zaman içerisinde A akımı tarafından kat edilen
mesafe db ft olduğundan arayüzeyden b uzaklıktaki A bileşeninin hızı,
Şekil-3: Tek faz boyunca akılar ve
hızlar; (a) difüzyon yönleriyle paralel faz bölgesi, (b) hızlar arasındaki
ilişkiyi gösteren vektör diyagramları; uA = u0A + u, uB = u0BA + u
Bu durum, eğer tüm A molekülleri aynı hızda yığın hareketi yönünde
hareket etseydi her A molekülünün durgun bir arayüzeye göre sahip olabileceği
hız olarak da yorumlanabilir. Benzer şekilde, aynı yerdeki B bileşeninin hızı,
uB,
Tüm fazın akış hızı NA + NB mol/saat
tir. Eğer fazın yoğunluğu ρM mol/ft3 ise, arayüzeyle
ilgili tüm fazın hızı,
Tüm fazın hareketsiz olması durumunda, u = 0 ve NA =
– NB dir. Tüm faz hareketsiz olsun ya da olmasın, bir bütün olarak
faza göre A ve B bileşenlerinin hızları u0A ve u0B olarak
gösterilmektedir. Bu bileşenlere uygun gelen akımlar N0A/A ve N0B/A
ayrıca tüm faza görecelidir.
Bu ilişkiler Şekil-3b de vektör diyagramlarında gösterilmiştir.
u0A ve u0B vektörlerinin farklı yönleri işaret ettiğine
dikkat ediniz. Onların eşit büyüklükte olmaları gerekli görülmemekle birlikte
Şekil-3’de ve Denklem (11 ve (12)’de de görüldüğü gibi bu durum sadece cA=cB
olduğunda doğrudur.
u0A, uA ve u’nun Denklem (13) den,
burada ρM karışımın lb mol/ft3
cinsinden molal yoğunluğudur. Denklem (15) ve (16) cA ve cB
için gerekli yer değiştirilmeler yapıldıktan sonra,
Bu denklemler transferin mekanizmasından bağımsızdır; hem
laminer hem de türbülent akıma uygulanabilir.
Moleküler
Difüzyon ve Laminer Akış için Birleştirilmiş Denklemler
Difüzyon sadece moleküler harekete dayandığı ve türbülans olmadığı durumda eğer Dm biliniyorsa, difüzyon denklemleri difüzyon hızını hesaplanmasını sağlamak için birleştirilebilir.
Eğer Dm sabitse Denklem (19), fazın belirli bir
kalınlığı için integre edilebilir. Konsantrasyon aralığının integrasyon B’ye
uzaklığı küçük olduğu zaman, bu varsayım ikili karışımların tüm
konsantrasyonlarında gerçekleşen gaz difüzyonu ve sıvı difüzyonu için
doğrulanabilir. Dm ‘nin küçük değişiklikleri için Dm uç
değerlerinin aritmetik ortalaması sabit olarak kullanılabilir. Difüzivite
sıcaklıkla değişirken, sıcaklık sabit veya yaklaşık olarak sabit olmalıdır.
y = A bileşeninin, b = B olduğu yerdeki mol kesri; yi
= A bileşeninin, b = 0 olduğu yerdeki mol kesri
Denklem (20), arayüzeydeki NA/A madde akışının, difüzivite
(Dm) ile doğru orantılı ve kalınlık B ile ters orantılı olduğunu
göstermekte olup, konsantrasyon değişimi veya konsantrasyon farkıyla ilişkili
değildir. Bunun yerine arayüzeye veya yüzeyden tüm fazın sapmasıyla
etkilenmektedir.
Denklem (20) iki bileşenli sistemler için geneldir ve
bileşenlerin bireysel akımlarının herhangi bir kombinasyonunu açıklar. İki özel
durum özellikle önemlidir.
Eşmolal (Eşitmolal) Difüzyon: Eşitmolal difüzyon
içerisinde, destilasyon işlemlerinde sıklıkça rastlandığı üzere NA +
NB sıfıra eşit olup NA = - NB. Böylece z’nin değeri,
Denklem (18)’den, sonsuz olur ve Denklem (20) geçersiz hale gelir. Denklem(19)
aşağıdaki bağıntıya göre kullanılır,
Ancak, z sonsuz olduğunda bu kesir bir birim olur. İntegrali
alındıktan sonra Eştlik (19) aşağıdaki hale gelir.
Bu sonuç eşitmolal difüzyon için N0A = NA
olduğuna dikkat edilerek Denklem (1) in direk integralinin alınmasıyla
bulunmasıyla aynıdır.
Tekbileşen Difüzyonu: Gaz absorbsiyonu, süzme ve
ekstraksiyonda, B bileşeni gibi rastgele seçilen bir bileşen arayüzeye göre
hareketsizdir, ve sadece bileşen A arayüzeye veya arayüzeyden difüzlenir. NB
= 0 ve Denklem (18) den z = 1 dir. Denklem (20) aşağıdaki hale dönüşür
Eşmolal difüzyonu halinde A ve B bileşenlerinin
konsantrasyon değişimleri Şekil 4a’da, tekbileşenli difüzyon için Şekil-4b’de görülmektedir.
Şekil-4: Eşmolal ve tekbileşen
difüzyonunda konsantrasyon değişimi; (a) A ve B bileşenleri aynı molal
hızlarda, ters yönlerde difüzlenirler, (b) A bileşeni difüzlenirken, B bileşeni
arayüzeye göre hareketsizdir.
Her iki durumda da, A bileşeni için konsantrasyonlar
arayüzeyde 0.9 ve dış sınırda 0.1 dir. Tekbileşenli difüzyonda NB
sıfır olmasına rağmen, B bileşeninin konsantrasyon değişimi sıfır değildir.
Eğer tüm faz B bileşeninin sıvı tabakası boyunca arayüzeye doğru ya da
arayüzeyden hareketini engellemek için gerekli hızda soldan sağa doğru hareket etseydi,
arayüzeye göre hareketsiz olan bir gözlemci değişimleri görebilirdi. Bu durum
yürüme bandı üzerinde ileriye doğru hareket eden birinin yürüme hızının geriye
doğru olan hızla eşit olduğu durumla benzerdir. Bileşen B bir bütün olarak bir
akım boyunca difüzlenir, fakat akımın kendisi aynı hızda zıt yönde hareket
eder, ve bileşen B arayüzeye göre hareketsizdir. Şekil-4 de belirtilen durumlar
arasında tüm fark göreceli hızların küçük miktarıdır.
Türbülent
Difüzyon
Momentum ve ısı enerjisini taşıdıkları gibi hareket eden
girdaplar bir türbülent akım içerisinde maddeyi bir yerden bir başka yere
taşır. Türbülent akımların içindeki momentum ve ısı transferi için verilen Denklem
(3-18) ve (12-47) nin benzerliğine dayanarak, kütle transferi için denklemler
şöyle olur,
N0A,t/A, A nın molal akımı olup bir bütün
olarak faza göre türbülent akımdan dolayı oluşur, ve EN ve ÎN girdap yayılma güçleridir. Tüm
faza göre toplam molal akım aşağıdaki aşağıdaki şekilde yazılır.
Madde, arayüzeye göre tüm fazın yukarı doğru hareketi olsun veya
olmasın, türbülent hareketle arayüzeye doğru veya diğer yönde transfer
olabilir. Sonuç denklem,
Kütle
Transferi Katsayıları
Arayüzeyi geçen akışın laminar olması durumunda kararlı
haldeki moleküler difüzyona dayanan Denklem (20) Dm ve B ilinmesi
durumunda kütle transfer hızlarının tahmin edilmesinde kullanılabilir. Bununla
birlikte, uzaklık B akışın laminar olduğu durumlarda bile daima bilinmeyebilir.
Bundan başka, eğer akım iyi tanımlanmış kanallardan geçiyorsa ve eğer akışkan
sıkıştırılmış kulelerde ayırma ve uyanma oluşumlarının olmasına olduğu gibi
katı şekillerle temas halinde geçiyor ise kritiğin üzerindeki Reynolds
sayılarında genel tampon bölge ve türbülent merkez görünür. Elek tabakası ve
sprey kolonlarında olduğu gibi spreyler veya kabarcıklardan ve onlara doğru
olan transfer basit moleküler difüzyon mekanizmasından çok daha farklıdır. Bu
gibi makinelerde kararlı bir hale varılacağı da şüphelidir. İlave bir komplikasyon
ise A nın gerçek arayüzey alanının sıklıkla bilinmiyor olmasıdır. Sıkıştırılmış
kulelerde, gerçek arayüzey alanı sıkıştırılmanın geometrik alanından daha az
olduğu varsayılırken püskürtücüler ve kabarcıklarda bu alan bilinmemektedir.
Prensipte, kütle transfer hızları Denklem (22) ile hesaplanabilirken gerçekte B
ve EN bilinmediği için bu doğru değildir. Kütle transferi aşağıdaki denklemte
tanımlandığı gibi kütle transfer katsayılarının kullanılmasıyla ele alınmaktadır.
k özel ısı transferi katsayısı h de olduğu gibi özel
kütle transfer katsayısını belirtir, ve Ф tüm fazın arayüzeye yaklaşan veya
uzaklaşan muhtemel hareketine neden olan göreceli bir hız faktörüdür. k
Katsayısı aşağıda verilen denklemle yayılma güçleriyle ilişkilendirilir.
EN bilinmeyen bir B uzaklığındaki ortalama
girdap yayıma gücü olarak kabul edilebilir. Böylece k, tüm fazın hareketinden
bağımsız moleküler ve türbülent difüzyon vasıtasıyla kütle transferine karı
direncin bir ölçüsü olur. Bu gibi hareketler sonu oluşa transfer Ф faktörü
aracılığıyla ayrıca dikkate alınır.
Denklem (23)'deki k nın tanımından y konsantrasyonu tüm
fazın ortalama konsantrasyonudur ve eğer akıtmam olarak karıştırılmış ise
ulaşılmaktadır. Bu durum, ısı transferinde h nin tanımlanmasında akımın
ortalama sıcaklığının kullanılmasına benzerdir. Konsantrasyon böylelikle
tanımlandığı zaman, onun madde dengesi içindeki kullanımıyla benzerlik
gösterir.
k Katsayısı bir Drew-Colburn katsayısıdır. Diğer kütle
transferi katsayıları kimya mühendisliği literatüründen bulunabilir, fakat
sadelik için Denklem (23) te tanımlandığı gibi bu kitap boyunca genellikle k
kullanılmıştır. V fazı için y ve L fazı için x altsimgeleri kullanılmaktadır. k
nın birimleri lb mol/ft2saat (birim mol kesri). Sayısal olarak, bu Ф
birim olduğu zaman birim mol kesrinin sürükleyici kuvveti altında 1 ft2
alan içerisinden geçen birim saatteki mol içindeki A bileşeninin akış hızıdır.
Relatif
Hız Faktör
Ф faktörü, aşağıdaki gibi bulunabilir.
Eşmolal difüzyon için N0A = NA dır.
Bir turbulent sistemdeki eşmolal difüzyon için Denklem(21) ün integrali alınır,
Denklem (23) ile (26)’nin karşılaştırılması equimolal difüzyon için Ф = 1 olduğunu göstermiştir. Bu durum akış ister laminar ister türbülent olsun doğrudur.
Tekbileşenli difüzyonda z = 1 olup Denklem (25) aşağıdaki
hali alır.
(yB)L, 1 - y ve 1 - yi
nin logaritmik ortalamasıdır. Burada göreceli hız faktörü inert veya hareketsiz
bileşenin sınır konsantrasyonlarının logaritmik ortalamasıdır.
Sıvılarda
Uygulanma
Denklem (23) ve (25) gazlara olduğu gibi prensipte sıvılara
da uygulanır. Gazlardaki difüzyondan farklı olarak, sıvılardaki Dm
konsantrasyonla değişir. Ayrıca, sıvılarda k ve Dm için deneysel
veriler, genellikle göreceli hız faktörünü içeren bir yolla tayin edilir. Bunun
yanında, Dm verileri seyreltik çözeltileri ikapsadığından, Ф
yaklaşık olarak bir birimdir. Bu nedenlerden sıvılar için Ф=1 alındığında Denklem(23)
genellikle sadeleşir; sıvı faz L fazı ise,
Difüzyonun Yönü
Yukarıdaki tartışmada, bileşen A nın arayüzeyden faza doğru
difüzlendiği varsayılmıştır. Bu bileşenin arayüzeyden çok, arayüzeye doğru
difüzlendiği daha uygundur. Aynı denklemler yi-y veya xi-x
için y-yi veya x-xi yazılarak kullanılabilir.
Kütle
Transferi Katsayılarının Deneysel Ölçümleri
Gerçek ekipmanlardaki kütle transferinin kompleksliğinden
dolayı, gerçek ekipmanlarda kütle transferi için temel denklemler uygun
değildir, ve uygun denklemler vermek için boyutsal analiz ve yarı teorik
benzerliklerin ışığında basit metotlara güvenilmektedir. Probleme yaklaşım
aşağıdaki adımlar takip edilerek yapılır:
1. k katsayısı fazlar arası etkileşim alanının bilindiği ve
sınır tabakaları ayırımının olmadığı yerlerdeki deneysel araçlarda
çalışılmıştır. Şekil-5 de gösterilen pratikte bazen kullanılan ıslak duvarlı
kule bu tipin genellikle kullanılan aygıtıdır. Türbülent akıştaki akışkanlardan
ve bu akışkanlara doğru olan kütle transferi hakkında değerli bilgiler
verilmektedir. Islak duvarlı kule sıvı dikey tüpün üzerinden verilmektedir ve
tüpün iç duvarı boyunca yerçekiminin etkisi altında aşağıya doğru akmaya neden
olur ve tüpün içerisine gaz akışkanla temas halinde kule içerisinden geçerek
akar. Genellikle gaz kulenin altından girer ve akışkanın akış yönüne ter olarak
akar, fakat paralel akışta kullanılabilir. Islak duvarlı kule içinde, akış
oluşumundaki bazı komplikasyonlar hariç arayüzey bilinmektedir ve çekim oluşumu
mevcut değildir.
2. Etkileşim alanının bilindiği diğer deneylerde
yapılmıştır. Yapılan işte kullanılan prensip, akan sıvı veya gaz akımının
içindeki katı şekillerden maddenin çözülmesi veya buharlaşma hızının
ölçülmesidir. Maddenin kendisinin katı kütlelerden çözülmesi veya
buharlaştırılması ya da ıslak katılardan sıvıların buharlaştırılması
kullanılmaktadır. Bu teknikte, alan bilinmektedir ve basit olarak buharlaşan ya
da eriyen katının alanı olarak kabul edilmektedir. Katının kendisinin
difüzyonundaki fazlar arasındaki arayüzeyde oluşan transfer edilen madde ile
ilgili komplikasyonlar yok edilmektedir. Bu noktada bulunan veriler ıslak duvar
deneylerindeki ilişkilerin sınır tabakaları ayırımının aktif olduğu durumlara
uygulanması için kullanılabilir.
3. Son olarak, gerçek dolgulu kuleler, filtre tabakaları ve
sprey araçları üzerine deneyler yapılmaktadır, ve 1. ve 2. paragrafta
belirtilen deneylerden elde edilen sonuçların önerdiği hatlarla ilgili veriler
bulunmuştur. Alan etkisi sadece k katsayısından ziyade ekipmanın birim
hacmindeki transfer alanı olan a nın kullanılmasıyla elde edilen ka katsayısı
ile hesaba katılmaktadır. Bulunan ilişkiler sadece k için değil ürün olan ka
içindir. Faktör a nın bağımsız olarak geliştirilmesi için bazı ilerlemeler
kaydedilmiştir, ve bu mümkün odlunda k katsayısı izole edilerek basit durumlar
içinde kullanılabilecektir.
k ve ka'nın değerlerini bulmak için yapılan deneyler, NA,
A, yi, yγ niceliklerinin deneysel ölçülmesi, transfer
şartlarına bağlı olarak Ф nın hesaplanması, Denklem(23) den k nın hesabı ya da
cihazın tüm uzunluğundan ortalaması alındıktan sonra denginin bulunmasını
içermektedir. Eğer A biliniyorsa ekipmanın toplam hacmi kullanılarak ka
hesaplanabilir. Boyutsal analiz, deneyleri planlamak için kullanılmaktadır ve
boyutsuz guruplarda ve denklemlerde oluşan sonuçlar yorumlanmaktadır. Sürtünme,
ısı transferi ve kütle transferi arasındaki benzerlikler faydalı birer
rehberdir.
Bu parçada, A alanının bilindiği hallerde sıvılar arasında
veya sıvılarla katılar arsında oluşan kütle transfer için ilişkiler
verilmektedir. Fazlar arsındaki alanın bilinmediği ekipmanlar için katsayılara
sonraki bölümlerde değinilecektir.
Şekil-5: Islak-duvarlı kule
BİLİNEN
ALANLARDA KÜTLE TRANSFER KATSAYILARI
Boyutsal analiz
Kütle transferinin mekanizmasından k katsayısının difüzivite
Dm ve akışın karakterini kontrol eden kütle hızı G, viskozite μ ve
bazı lineer boyutlara D dayanması beklenmektedir. Arayüzeyin şeklinin süreci
etkilemesi beklenebilir ki her şekil için farklı bir ilişki oluşmalıdır.
Transfer yüzeyinin herhangi bir şekli için,
Burada M tüm fazın ortalama molekül ağırlığıdır. Her
ikisinin de molal nicelik olmasından dolayı tutarlılık için k ve Dm
kullanılmaktadır. Denklem (27) Colburn’ün ısı transferine benzer. Nusselt’in
ısı transferine benzeyen ikinci boyutsuz denklem, Denklem (27)’nin (DG/ μ) (μ/DmM)
ile çarpılmasıyla bulunur:
Gurup kD/Dm Sherwood sayısı olarak
adlandırılmaktadır ve NSh olarak ifade edilir. Bu sayı ısı
transferindeki Nusselt sayısına benzer. Gurup μ/DmM Schmidt sayısı
olarak anılır ve NSc ile gösterilir. Bu sayı Prandtl sayısına
tekabül etmektedir. Schmidt sayı sıklıkla μ/ρDv olarak yazılmakta
olup buradaki ρ, lb/ft3 içindeki fazın yoğunluğudur. Tipik değerler Ek 17 de verilmiştir.
Gurup DG/m ise Reynolds sayısına karşılık gelir ve NRe ile gösterilir.
Gurup DG/m ise Reynolds sayısına karşılık gelir ve NRe ile gösterilir.
Islak
Duvarlı Kuleler
Islak duvarlı kuleler için çeşitli ilişkiler mevcuttur
(Şekil-5). Gillilan-Sherwood eşitliğin göre,
Bu denklem Reynolds sayısının 2000 den 35000’e kadar olan
değerleri için, Schmidt sayısının 0.60 tan 2.5’ğa kadar olan değerleri için ve
0.1 den 3 atmosfere kadar olan basınçlarda uygulanabilir.
Islak duvarlı kuleler için JM, şöyle yazılabilir:
Burada f pürüzsüz düzgünlükteki borulardaki akış için
Fanning sürtünme faktörüdür. Bu ilişki ıslak duvarlı kulelerdeki düzeltme ve
absorpsiyon için yeterince tatmin edicidir. Bu denklemte görülen benzerlik aynı
ekipmandaki ısı ve kütle transferi için geneldir. Bir yanda ısı ve kütle
transferi arasındaki benzerlik diğer yanda sürtünme kuvvetinin benzerliği
yalnızca kabuk sürtünmesi için geçerlidir. Eğer akımın ayrılmasından bir
sürüklenme mevcutsa toplam sürtünme için uygulanmaz.
Tekli
Silindirlere Dik Akış
Şekil-6 da tekli silindirlere dik akış için jM in
NRe ile olan ilişkisi gösterilmektedir. Çizgi ile gösterilen hat ısı
transfer faktörü jH noktalarını verir. Bu hat, bu sistem için ısı ve
kütle transferi arasındaki yakın ilişkiyi gösterir.
Tek
Kürelerden Geçen Akış
Şekil-7 de NSH ‘ye karşı NRE NSC2/3
gösterilmiştir. Bu şekildeki hat NRE NSC2/3
nin düşük değerleri için NSH = 2.0 asimptotuna yaklaşır.
Şekil-6: Isı ve kütle transferi,
akış tek silindirleri geçer
Şekil-7: Isı ve kütle transferi,
akış tek küreleri geçer
Şekil-8: Isı ve kütle transferi,
katı yataklar içinden akış
Dolgulu ve Akışkan Yataklarda Kütle
Transferi
Çeşitli partikül türlerinin yatakları ve akışkanlar
arasındaki kütle transferine ait veriler Şekil-8 deki eğride özetlenmiştir. Bu
noktalarda jM faktörü yatağın Î
porozitesiyle çarpılır ve transfer için uygun alanı ölçen f faktörüne bölünür.
Kürelerin yataklarında sabitlenmiş ya da akışkan için f=1000 olup diğer
partiküllerin değerleri Tablo-2’de verilmektedir. Şekil-8 deki absis, içinde
lineer boyutun tek bir Av partikülünün toplam yüzey alanının
karekökü olduğu özel bir Reynold sayısı N’RE dır.
Şekil-8 de kesikli çizgi sabit yatak içindeki kürelerin
yüzeyine olan ısı transferini gösterir. Kütle transferi ile ilgili veriler
arasında bir uyum bulunmaktadır.
KÜTLE
TRANSFERİNİN PENETRASYON TEORİSİ
Türbülent akımdan durgun bir yüzeye ısı transferinde ısı
transferi hızını belirlemeye yarayan iki model vardır. Bunlardan ilki olan kararlı
hal denge laminer tabakası teorisi, transferin sadece iletimle olduğu laminar
hareket içinde sürtünmeli bir filmin varlığını öngörür. Diğer model akışkanın
elementlerin türbülent merkezden durgun yüzeye doğru aktığını, orada kısa bir
süre bekledikten sonra akışkan yığınındaki diğer elementlerle yer değiştirdiğin
varsaymaktadır. Yer değiştirme zamanı mekanik elementin hareketi ile yönlenir
ki hasarlı yüzey değiştiricide olduğu gibi zaman tr bilinir ve ısı
transfer katsayısı ile belirlenir. Türbülent akımda yerleşme zamanı bilinmez, ayrıca
tüm akışkan elementler için bu değer aynı değildir. Bununla birlikte, eğer tL
yüzeydeki akışkan elementlerin etkili ortalama yerleşme zamanı olarak
tanımlanırsa türbülent sıvıdan katı yüzeye ısı transferi eşitliği uygulanabilir.
Teori, arayüzeye olan kütle transferi sürecine de
uygulanabilir. Buna göre akışkan elementler ve arayüzey arasındaki kütle
transferinin tamamiyle moleküler difüzyonla olduğu varsayılır. Şartlar zamanla
değiştiğinden akışkan element içerisindeki herhangi bir yerdeki konsantrasyon
aşağıdaki eşitliğe göre değişkenlik gösterir; burada b arayüzeyden olan uzaklıktır.
Basitlik için, arayüzeyden veya arayüzeye doğru difüzyonun eş-molal
olduğu varsayılır ve göreceli hız faktörü bir birimdir. Bu şartlar altında
transfer akımı aşağıdaki denklemle verilir.
tL akışkan elementlerin arayüzeyde kaldığı ortalama zamandır. Buradan, eş-molal difüzyon için bireysel kütle transfer katsayısı,
tL akışkan elementlerin arayüzeyde kaldığı ortalama zamandır. Buradan, eş-molal difüzyon için bireysel kütle transfer katsayısı,
Yüzey-yenilenmesi modeli denk molal difüzyonla sınırlı değildir. Göreceli hız faktörü bir birimde farklı olduğu zaman kütle transfer katsayısı bu denklemle verilir; fakat transfer akım için denklem aşağıdaki hali alır.
tL zamanı akışkan hızı, özellikleri ve sistem geometrisinin bir fonksiyonudur. Deneysel olarak tayin edilmelidir. Isı transferiyle bazı durumlarda yüzey yenilenme modelinin transfer sürecini film teorisinden daha gerçekçi olarak temsil ettikleri görülmüştür. Bu model özellikle transfer yüzeyinin kazınmış yüzey biriminde olduğu gibi dışarıdan veya sürekli bir faz içindeki kabarcıkların veya damlaların akışıyla yenilendiği ya da etkilendiği durumlar için yararlıdır.
EK 17.
GAZLARIN HAVADAKİ DİFÜZİVİTELERİ
VE SCHMİDT SAYILARI
VE SCHMİDT SAYILARI
1 atm. ve 32 0F da
Difüzivite
|
NSc
= m / r Dv
NSc
= m / M Dm
|
||
Volumetrik,
Dv, ft2/sa
|
Molal,
Dm, lb.mol/ft.sa.103
|
||
asetik asit
|
0.413
|
1.15
|
1.24
|
aseton
|
0.32
|
0.89
|
1.60
|
amonyak
|
0.836
|
2.33
|
0.61
|
benzen
|
0.299
|
0.83
|
1.71
|
n-bütil alkol
|
0.273
|
0.76
|
1.88
|
karbon dioksit
|
0.535
|
1.49
|
0.96
|
karbon tetraklorür
|
0.24
|
0.67
|
2.13
|
klor
|
0.36
|
1.00
|
1.42
|
klorobenzen
|
0.24
|
0.67
|
2.13
|
etan 0.42
|
1.17
|
1.22
|
|
etil asetat
|
0.278
|
0.77
|
1.84
|
etil alkol
|
0.396
|
1.10
|
1.30
|
etil eter
|
0.302
|
0.84
|
1.70
|
hidrojen
|
2.37
|
6.60
|
0.22
|
metan
|
0.61
|
1.70
|
0.84
|
metil alkol
|
0.515
|
1.43
|
1.00
|
naftalin
|
0.199
|
0.55
|
2.57
|
azot
|
0.52
|
1.45
|
0.98
|
n-oktan
|
0.196
|
0.546
|
2.62
|
oksijen
|
0.690
|
1.92
|
0.74
|
fosgen
|
0.31
|
0.86
|
1.65
|
propan
|
0.34
|
0.95
|
1.51
|
sülfür dioksit
|
0.40
|
1.11
|
1.28
|
toluen
|
0.275
|
0.77
|
1.86
|
su buharı
|
0.853
|
2.38
|
0.60
|
GERİ (proje çalışmaları)