Bir elektrolit çözeltisindeki elektrik iletimi, pozitif
yüklü taneciklerin katoda, negatif yüklü taneciklerin de anoda göç etmeleri
olayıdır. "İletkenlik" akım ölçüsüdür ve çözeltideki yüklü
taneciklerin sayısı ile doğru orantılıdır. İyonların tümü iletkenliğe katkıda
bulunur; herhangi bir taneciğin taşıdığı bir akım, o taneciğin konsantrasyonuna
ve ortamdaki hareket yeteneğine bağlıdır.
Analizlerin doğrudan doğruya iletkenlik ölçümlerine
dayanılarak yapılması, taneciklerin özellikleri nedeniyle, sınırlıdır. Bir
çözeltinin toplam iletkenliğine çözeltideki her tür iyonun katkıda bulunması
nedeniyle iyon karışımlarının bulunduğu çözeltilerde doğrudan iletkenlik
ölçümünün seçici özelliği yoktur. Ancak yöntemin hassasiyeti yüksek olduğundan
bazı uygulamalarda çok önemlidir. En fazla kullanıldığı alan distile veya
deiyonize suyun saflığının kontrolüdür. Saf suyun öz iletkenliği 5 x 10-8
ohm-1 cm-1 kadardır; eser miktardaki iyonik safsızlıklar
iletkenliği önemli derecede artırır.
İletkenlik ölçümleri bir tek kuvvetli elektrolit içeren
(alkaliler veya asitler gibi) çözeltilerin konsantrasyonlarının saptanmasında
uygulanır. Bu tür analizlerde kalibrasyon eğrileri kullanılır. Ölçüm, ağırlıkça
%20 ye kadar madde bulunan çözeltilerde yapılabilir. Deniz suyunun tuzluluk derecesi
de iletkenlik ölçümleri ile saptanabilir. İletkenlik ölçümleriyle, bir veya
daha fazla iyonik taneciğin bulunduğu sulu çözeltilerin asosiyasyon ve
disosiyasyon özellikleri hakkında bilgi edinilebilir.
Yöntemin en önemli avantajı, çok seyreltik çözeltilere ve
reaksiyonun tam olmadığı sistemlere de uygulanabilmesidir. Örneğin, seyreltik
fenol (Ka »10-10)
çözeltisinin, potansiyometrik veya indikatör dönüm noktası yöntemi ile
yapılamayan analizi bu yöntemle yapılabilir. Toplam elektrolit konsantrasyonunun
artmasıyla yöntemin doğruluğu azalır. Titrant ilave edildiğinde oluşan akım
değişikliği, çözeltideki tuz konsantrasyonu fazla olduğunda maskelenir.
ELEKTROLİTİK
İLETKENLİK
Bir çözeltiye potansiyel uygulandığında, çözeltideki iyonlar
ters yüklü elektrotlara doğru hareket ederler. Ancak hareket hızları, bu
iyonların göç etmeleriyle oluşan sürtünme kuvvetleri tarafından sınırlanır.
Metalik bir iletkende olduğu gibi çözeltide de, taneciklerin hızı uygulanan
alanla doğrusal bir ilişkidedir; yani ohm kanununa uyar.
İletkenlik, G
Bir çözeltinin iletkenliği, elektriksel direncin (R)
tersidir ve birimi ohm-1 (W-1), veya Siemens (S) dir.
Öz (Spesifik) iletkenlik, k
İletkenlik, bir iletkenin kesit alanı (A) ile doğru,
uzunluğu (l) ile ters orantılıdır.
A ve l sayısal olarak birbirine eşit olduğu zaman öz
iletkenlik iletkenliğe eşit olur (k = G). Birimler santimetre cinsinden
verildiğinde k, kenarı 1 cm olan bir sıvı küpünün iletkenliğini gösterir. Buna
göre öz iletkenliğin birimi ohm-1 cm-1 (S/cm); birimler
metre olarak verildiğinde S/m dir.
İletkenlik ölçümleri için sıcaklık katsayısı %2/0C
kadardır; bu nedenle, kondüktometrik bir ölçüm yapılırken sıcaklık kontrolüne
gerek vardır. Deneylerin sabit bir sıcaklıkta yapılması tavsiye edilir, ancak
bazı durumlarda sıcaklık kontrolüne gerek olmaz. Pek çok hallerde hücre, oda
sıcaklığındaki bir su veya yağ banyosuna daldırılarak, ayrıca bir sıcaklık
kontrolüne gerek kalmaz.
Şekil-1: Bazı
bileşiklerin öz iletkenliğinin konsantrasyonla değişimi
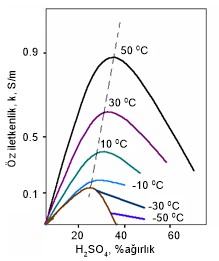
Şekil-2: Farklı
konsantrasyonlardaki H2SO4’in öz iletkenliğinin
sıcaklıkla değişimi
Eşdeğer (Ekivalan) İletkenlik, Λ
Eşdeğer iletkenlik (Λ), birbirinden 1 cm uzaklıktaki iki
elektrot arasında bulunan 1 eşdeğer gram maddenin iletkenliği olarak tarif
edilir.
Burada çözeltinin hacmi ve elektrotların alanları
belirtilmez; bunlar koşullara göre değişir. Örneğin, çözelti 1 N (litrede 1.0
eşdeğer gram) ise her bir elektrot yüzeyin alanının 1000 cm2 olması
gerekir; çözeltinin 0.1N olması halinde ise 10000 cm2 'lik yüzey
alanlı elektrotlar gerekir. Bu nedenle, doğrudan eşdeğer iletkenlik ölçümüne
dayanan analizler pek sık yapılmaz. Bunun yerine, eşdeğer iletkenlik değeri öz
iletkenlik verisinden dolaylı olarak bulunur.
Tarife göre, aralarında 1 cm mesafe bulunan iki elektrot
arasında 1 eşdeğer gram madde varsa Λ değeri G'ye eşit olur. 1 eşdeğer gram
madde içeren çözeltinin hacmi (V, cm3),
eşitliği ile verilir. Burada C, her bir litredeki
konsantrasyonu (eşdeğer olarak) gösterir. Hacim, hücrenin boyutlarına göre de
tarif edilebilir.
V = l A
l = 1 cm olarak sabit tutulduğunda,
Molar İletkenlik (Λm): Birbirinden 1 m
uzaklıktaki iki elektrot arasında bulunan 1 mol elektrolitin iletkenliğini
gösterir.
Bu eşitlikler kullanılarak konsantrasyonu bilinen bir
çözeltinin deneysel olarak bulunan k değerinden eşdeğer veya molar iletkenlikleri
hesaplanabilir.
Şekil-3: Bazı
bileşiklerin molar iletkenliğinin konsantrasyonla değişimi
Sonsuz Seyrelmedeki Eşdeğer İletkenlik
Çözeltideki bir iyonun hareketliği dört kuvvetin
etkisindedir. "Elektriksel kuvvet", elektrotun potansiyeli ve iyonun
yükünden oluşan elektrik kuvvetidir; taneciklerin elektrotlardan sadece birine
doğru hareket etmesini sağlar. "Sürtünme kuvveti", her iyon için
karakteristik bir özelliktir; elektriksel kuvveti kısmen dengeler. Bu iki
kuvvet seyreltik bir çözeltinin iletkenliğinin tayininde çok önemlidir; bu
kuvvetlerin bulunduğu ortamda bir tuzun eşdeğer iletkenliği konsantrasyonuna
bağımlı değildir. Çok seyreltik olmayan konsantrasyonlarda iyon hareketliliğini
etkileyen iki kuvvet daha ortaya çıkar, bunlar "elektroforetik" ve
"relaksasyon" kuvvetlerdir. Bu kuvvetler, maddenin konsantrasyonu
arttıkça eşdeğer iletkenliğin azalmasına yol açar. Sodyum klorür çözeltisinin
konsantrasyonla gösterdiği eşdeğer iletkenlik değişimi Tablo- 1'de
görülmektedir.
Elektroforetik etki, analizi yapılacak iyonu saran zıt yüklü
iyonların hareketliğinden kaynaklanır. Bunlar beraberlerinde çözücü
moleküllerini de taşırlar; ana taneciğin hareketi, çözücünün ters yöndeki akışı
ile yavaşlatılır. Relaksasyon kuvveti de, taneciği saran iyonik atmosferin
hareketliliği ile ilgilidir; hareketli taneciğin arkasında toplanan zıt
işaretli yük, iyonun hareketini yavaşlatır.
Kuvvetli elektrolitlerde eşdeğer iletkenlik ile
konsantrasyonun kare kökü arasında doğrusal bir bağıntı vardır. Bu bağıntıdan
elde edilen doğrunun sıfır konsantrasyona ektrapole edilmesiyle sonsuz
seyrelmedeki eşdeğer iletkenlik (Λ0) bulunur. Zayıf bir
elektrolitin benzer şekilde elde edilen eğrisi bir doğru vermez ve Λ0
ın elde edilmesi de mümkün olmaz.
Sonsuz seyrelmede iyonlar arasındaki çekim kuvvetleri
sıfırdır; bu halde, çözeltinin toplam iletkenliği her bir iyonik eşdeğer
iletkenliğin toplamına eşittir.
Λ0 = l0+ + l0-
l0+
ve l0- tuzun
sonsuz seyrelmedeki katyon ve anyonunun eşdeğer iyonik iletkenlikleridir.
İyonik iletkenliklerin her biri, diğer elektrolitik ölçmelerden bulunabilir;
bazı iyonların eşdeğer iletkenlikleri Tablo-2'de verilmiştir. ½ Mg+2,
1/3 Fe+3 ve ½ SO4-2 gibi semboller,
konsantrasyonun eşdeğer/L cinsinden verildiğini gösterir.
Çeşitli taneciklerin eşdeğer iyonik iletkenliklerinin farklı
olması, büyüklüklerinin ve hidrasyon derecelerinin değişik olmasından dolayıdır
(Tablo-2).
Eşdeğer iyonik iletkenlik, elektriksel bir kuvvet alanı
altındaki bir iyonun hareket yeteneğini gösterir ve tabii iyonun elektrik
nakletme kapasitesinin de bir göstergesidir. Örneğin, bir potasyum iyonunun
iyonik iletkenliği bir klorür iyonununki ile hemen hemen aynidir; sonuçta, bir
potasyum klorür çözeltisinden geçen elektrik çözeltideki potasyum ve klorür
iyonları tarafından eşit olarak taşınır. Oysa hidroklorik asit durumunda olay
farklıdır; hidrojen iyonunun hareket yeteneği çok büyük olduğundan elektrolizde
elektriğin büyük bir bölümü [350/(350+76) = 0.82] hidrojen iyonu tarafından
taşınır.
İyonik iletkenlik verileriyle çeşitli maddelerin relatif
iletkenlikleri kıyaslanabilir. Örneğin, 0.01 N hidroklorik asidin 0.01N sodyum
klorürden daha fazla iletkendir denebilir, çünkü hidrojen iyonunun iyonik
iletkenliği çok büyüktür. Bu bilgiler kondüktometrik titrasyonda başarılı olmak
için çok önemlidir.
Sonsuz Seyrelmedeki
Molar İletkenlik, Λ¥m
Kohlrausch, elektrolit konsantrasyonunun C< 0.002~0.003
olması halinde, Lm
ve C1/2 arasınsa doğrusal bir ilişki olduğunu göstermiştir.
Şekil-4: Molar
iletkenlik Λm ve C½ arasındaki ilişki
Kohlrausch’un molar iletkenlik deneysel formülü:
Λm = Λ¥m – A C½ eşitliği ile verilir.
C = 0 olduğunda, Λm = Λ¥m
Λ¥ m: sonsuz seyrelmedeki sınır değeridir; buna,
“sınır molar iletkenlik” denir.
Bir
Hücredeki Değişken (Alternatif) Akımlar
Bir çözelti-elektrot yüzeyi boyunca doğru akım(dc) elektrik
iletimi faradaik bir işlemdir; yani iki elektrottan birinde yükseltgenme ve
diğerinde de indirgenme reaksiyonunun olması gerekir. Oysa alternatif akım(ac)
için elektrotlarda elektrokimyasal reaksiyona gereksinim yoktur; bundaki
elektrik akımı, faradaik olmayan işlemler sonucunda gerçekleşir. Faradaik
iletkenlikle ilgili değişiklikler hücrenin elektriksel özelliklerini de
değiştirdiğinden kondüktometrik ölçmeler faradaik olmayan işlemlere göre
yürütülür.
Düşük frekanslarda, bir elektrolitten ac elektrik iletimi
iyonların elektrotlara doğru ve elektrotlardan da ters yöne doğru olan
periyodik hareketlerinden kaynaklanır. Radyo frekanslarında, taşınan elektriğin
bir kısmı "tesir ve düzenlenme polarizasyonu" nedeniyle dielektrik
akım şeklindedir. Bu etkiden kurtulmak için iletkenlik ölçümleri, çoğunlukla,
düşük frekanslarda yapılır. "Osilometre" denen bir cihazda ise radyo
frekansları kullanılır; bunda dielektrik akım önemlidir.
İLETKENLİĞİN
ÖLÇÜLMESİ
İletkenlik ölçümü için bir elektrik güç kaynağına,
çözeltinin bulunduğu bir hücreye, ve çözeltinin direncini ölçebilen uygun bir
köprüye gereksinim vardır.
Güç
Kaynakları
Alternatif akım kullanılmasıyla faradaik akımlardan
kaynaklanan etkiler yok edilir. Bunun için uygulanan frekansların hem üst hem
de alt limitleri kontrol edilmelidir; 1000 Hz dolayında sinyaller veren ses
osilatörleri bu amaç için en uygun kaynaklardır.
Hassasiyetin daha az olabileceği çalışmalarda kademeli
olarak 110 V'dan 10V'a kadar inebilen 60 saykıllık bir akım kullanılabilir.
Böyle bir akımla yapılan çalışmalarda iletkenlik ölçümleri, faradaik işlemler
nedeniyle, sınırlıdır. Ancak, 60 saykıllık bir gücün kolay bulunabilir olması
bu yöntemin avantajlı tarafıdır.
1000 Hz gibi yüksek frekanslı güç kaynakları kullanıldığında
bazı sorunlarla karşılaşılır. Burada, hücre kapasitansı ve devrenin diğer
kısımlarındaki parazit kapasitansları akımda faz değişikliklerine yol açarlar,
ve bunların uyumlu hale getirilmesi de oldukça zordur.
Direnç
Köprüleri
İletkenlik ölçmelerinde kullanılan tipik bir sistem
Wheatstone köprüsüdür (Şekil-5). Güç kaynağı S, 6-10 V potansiyelde, 60-1000 Hz
frekans aralığında bir alternatif akım verir. RAC ve RBC
dirençleri C nin konumundan hesaplanabilir. Bilinmeyen Rx dirençli
hücre köprünün üst sol kolu üzerine, hassas değişken RS direnci de
sağ kol üzerine yerleştirilir. D ve C arasında akımın bulunmadığını göstermek
için ND sıfırlama dedektörü kullanılır. Kulak, 1000 Hz frekansı
algılayabildiğinden dedektöre bir çift kulaklık takılabilir; veya kulaklık
yerine bir "göz" tüpü, bir katot ışını tüpü, veya bir mikroommetre
bulunabilir. Rs ‘deki değişken kapasitörle (kondansatör) Rx 'deki
(yüksek dirençler ölçülürken hassasiyet kaybolmasına neden olan) kapasitans
etkileri giderilir.
İletkenlik ölçmelerinde, iletkenliğin bir doğru akım
aletinden veya kaydediciden okunduğu , basit bir elektronik devre de
kullanılabilir (Şekil-6).
Şekil-5:
Direnç ölçümünde kullanılan bir Wheatstone
köprüsü
Şekil-6:
İletkenlik ölçümünde kullanılan basit bir devre
Hücreler
Şekil-7'de iletkenlik ölçümlerinde kullanılan bazı hücre
tipi görülmektedir. Bunların her birinde, geometrik olarak birbirine belirli ve
sabit bir konumda olacak şekilde yerleştirilmiş birer çift elektrot vardır.
Elektrotlar, etkin yüzeylerinin artırılması için, platinlenmişlerdir ve tabii
kapasitansları da yüksektir; bunun sonucu olarak faradaik akımlar en düşük
düzeydedir.
Şekil-7:
İletkenlik ölçümlerinde kullanılan tipik hücreler
Hücre
Sabitinin Saptanması
Denklem(2)ye göre öz iletkenlik k, ölçülen iletkenlik G den,
elektrotları birbirinden ayıran mesafenin (l), yüzey alanına (A) bölünmesiyle
elde edilen oran kadar farklıdır. Bu oran her bir hücre için sabit bir değerdir
ve "hücre sabiti" olarak adlandırılır.
Değeri, genellikle tayin edilmez; bunun yerine öz
iletkenliği bilinen bir çözeltinin iletkenliği ölçülür, sonra hücre sabiti
hesapla bulunur. Hücre kalibrasyonunda, çoğunlukla, potasyum klorür çözeltileri
kullanılır. Tipik veriler Tablo-3'de görülmektedir. Hücre sabiti bir defa tayin
edildikten sonra, denklem(2) ile, iletkenlik verileri kolayca öz iletkenliğe
çevrilir.
KONDÜKTOMETRİK
TİTRASYONLAR
Kondüktometrik ölçmelerde dönüm noktaları titrasyon
işleminin içinde bir noktada bulunur. Titrasyon eğrisinin çizilmesi için
eşdeğerlik noktasından önce ve sonra en az 3-4 ölçüm yapılmalıdır. Hacim
düzeltmesinden sonra bulunan iletkenlik verileri, titrant hacminin fonksiyonu
olarak grafiğe geçirilir. Çizilen iki doğru ektropole edilerek kesiştikleri nokta
eşdeğerlik noktası olarak saptanır.
Reaksiyonlar tamamlanmaya yakınlaştıkça yavaşladığından
kondüktometrik titrasyon eğrileri, eşdeğerlik bölgesinde doğrusallıktan
saparlar. Reaksiyonların zayıflığı artıkça ve çözeltinin konsantrasyonu
azaldıkça eğri şeklindeki bölgeler daha geniş olur. Eğrinin doğru şeklindeki
kısımları eşdeğerlik noktasından yeteri kadar uzaktaki kısımlarda daha kesin ve
doğru olarak belirlenir, çünkü tayin edilen iyonun reaksiyonu bu kısımlarda
hemen hemen tamamlanmıştır. Bu nedenle, potansiyometrik ve indikatör
yöntemlerinin tersine, kondüktometride dönüm noktalarının belirsiz olduğu
analizler bile başarıyla yapılabilir. Oysa potansiyometrik ve indikatör
titrasyonlarla bu tip reaksiyonlar doğru olarak izlenemez. Kondüktometrik dönüm
noktası spesifik bir nokta değildir.
Her tip volumetrik reaksiyonlara uygulanabilir olmasına
rağmen, yükseltgenme- indirgenme reaksiyonlarında kullanımı sınırlıdır; bu tip
reaksiyonlarda fazla miktarda hidrojen bulunması nedeniyle, volumetrik
reaksiyonlar sonucu oluşan iletkenlik değişiklikleri, hidrojen tarafından
maskelenir.
Asit-
Baz Titrasyonları
Kondüktometri, nötralizasyon titrasyonlarında dönüm
noktasının belirlenmesinde başarıyla uygulanabilir; çünkü hidrojen ve hidroksil
iyonlarının iyonik iletkenlikleri çok büyüktür.
Kuvvetli
Asitlerin veya Bazların Titrasyonu
Şekil-8'deki kesikli çizgi, hidroklorik asidin sodyum
hidroksit ile titrasyonunu gösterir (hacim düzeltmesi yapıldıktan sonra).
Nötralizasyon sırasında, hidrojen iyonları eşdeğer miktardaki daha az hareketli
sodyum iyonları ile yer değiştirir. Bu değişme sonucunda iletkenlik düşük
değerlere iner. Eşdeğerlik noktasında hidrojen ve hidroksil iyonları
konsantrasyonları en az seviyededir ve çözeltinin iletkenliği de en düşük
değeri gösterir. Sodyum ve hidroksil iyonu konsantrasyonunun artırılmasıyla,
eğrinin eğimi tersine döner. Tam eşdeğerlik noktasının bulunduğu bölgenin
dışında, iletkenlik ile ilave edilen bazın hacmi arasında çok güzel doğrusal
bir bağıntı vardır; sonuç olarak, bir analiz için eşdeğerlik noktasının her iki
tarafında üç veya dört gözlem noktası alınması yeterlidir.
Kuvvetli bir asitin veya bazın titrasyonu sırasında
iletkenliğin % değişimi, çözeltinin konsantrasyonuna bağlı değildir. Bu da çok
seyreltik çözeltilerin de konsantre çözeltiler kadar sağlıklı bir şekilde
analiz edilebileceğini gösterir.
Şekil-: 8:
Kuvvetli bir asitin, kuvvetli bir baz ile kondüktometrik titrasyonu
Zayıf
Asitler veya Bazların Titrasyonu
Şekil-9(a)'da çok zayıf bir asit olan borik asitin (Ka
= 6 x 10-10) kuvvetli bir bazla titrasyonundaki kondüktometrik dönüm
noktası tayini görülmektedir. Bu reaksiyon tamamlanan bir reaksiyon
olmadığından potansiyometrik veya indikatör dönüm noktası yöntemlerine
uygulanamaz. Titrasyonun başlarında hızla bir tampon ortam oluşur ve çözeltinin
hidrojen iyonu konsantrasyonu hemen hemen sabit kalır. İlave edilen hidroksil
iyonları bu tampon tarafından tüketilir ve dolaysıyla iletkenliğe doğrudan bir
katkıda bulunamazlar. Ortamdaki borat ve sodyum iyonlarının artmasıyla
iletkenlikte de yavaş bir artış gözlenir. Eşdeğerlik noktasına ulaşıldığında
artık daha fazla borat iyonu oluşamadığından, ilave edilen bazın çok hareketli
olan hidroksil iyonu nedeniyle iletkenlikte hızlı bir artış başlar.
Şekil-9(b)'de orta derecede zayıf bir asit olan asetik
asitin (Ka = 10-5) sodyum hidroksitle titrasyon eğrisi
çizilmiştir. Titrasyon eğrisinin başlangıcında gözlenen doğrusal olmayan bölge,
dönüm noktasının saptanmasını zorlaştırır. Çözeltinin başlangıçtaki hidrojen
iyonu konsantrasyonu orta derecelerdedir (~10-3 M). Baz ilave
edildiğinde bir tampon sistemi oluşur ve hidrojen iyonu konsantrasyonu daha da
düşerken sodyum iyonu ile asitin konjuge bazının konsantrasyonu artar. Hidrojen
iyonunun azalması ile, başlangıçta, iletkenlikte bir düşme gözlenir. Titrasyon
ilerledikçe, tampon oluşumu nedeniyle pH kararlı hale gelir ve bu durumda ortamdaki
tuz miktarı önemli olur; tuzun konsantrasyonu artıkça iletkenlikte de doğrusal
bir yükselme başlar. Eşdeğerlik noktasından sonra ortama ilave edilen bazın çok
hareketli hidroksil iyonları hakim olur ve iletkenlikteki doğrusal artış
hızlanır.
İlke olarak, zayıf asitler veya bazların tüm titrasyon
eğrileri Şekil-9(b)'deki gibi bir görümdedirler. Çok zayıf taneciklerin
iyonizasyonu çok yavaş olduğundan, tampon bölgenin oluşmasıyla ya hafif bir
eğri bölge meydana gelir veya böyle bu bölge hiç gözlenemez. Asitin (veya
bazın) kuvveti artıkça titrasyon eğrisinin ilk kısmı daha uzun olur.
Disosiyasyon sabitleri 10-5 den daha büyük olan zayıf asitler ve
bazlar için bir dönüm noktasının gözlenmesi imkansızlaşır.
Şekil-9(c)'de, Şekil-9(b)'deki zayıf asitin (asetik asit)
sulu amonyakla yapılan titrasyon eğrisi görülmektedir. Burada titrantın zayıf
bir elektrolit olması nedeniyle eğri, eşdeğerlik noktasından sonra yatay bir
görünüm almıştır. Titrant olarak sodyum hidroksit gibi kuvvetli bir baz yerine
sulu amonyak (zayıf bir baz) çözeltisi kullanılması halinde ekstrapolasyon
fazla sağlıklı olmaz.
Şekil-9(d)'deki eğri, asetat iyonu gibi, zayıf bir bazın
standard bir hidroklorik asit çözeltisiyle titrasyonunu göstermektedir. Ortama
kuvvetli asit ilave edilmesiyle sodyum klorür ve disosiye olmamış asetik asit
oluşmaya başlar. Asetat iyonlarının yerini alan klorür iyonları daha hareketli
iyonlar olduğundan iletkenlikte hafif bir yükselme gözlenir. Dönüm noktası
geçildikten sonra ortamda fazla hidrojen iyonları bulunacağından iletkenlikte
de hızlı bir yükselme başlar. Kondüktometrik yöntem, asidik veya bazik
karakteri çok zayıf olduğundan indikatörlerle iyi bir dönüm noktası bulunamayan
tuzların analizine çok uygundur.
İyonlaşma dereceleri birbirinden farklı olan iki asit
karışımının titrasyon eğrisi Şekil-9(e)'de görülmektedir. Bu tip karışımlarda,
potansiyometrik yöntemlere kıyasla, kondüktometrik analizlerde çok daha doğru
sonuçlar alınır.
Şekil-9:
Tipik kondüktometrik titrasyon eğrileri
Çökelme
ve Kompleks-Oluşumu Titrasyonlar
Şekil-9(f)’deki eğri sodyum klorürün gümüş nitrat ile
titrasyonundaki iletkenlik değişimini gösterir. Titrantın ilavesiyle
çözeltideki klorür iyonları, daha az hareketli nitrat iyonlarıyla yer
değiştirmeye başlar; iletkenlikte, bu nedenle, az bir düşme gözlenir. Reaksiyon
tamamlandıktan sonra gümüş nitratın fazlası iletkenliğin hızla yükselmesine yol
açar.
Çökelme veya kompleks-oluşumu reaksiyonlarına dayanan
kondüktometrik yöntemler, nötralizasyon reaksiyonlarında olduğu kadar yaygın
değildir. Hiç bir iyon, hidrojen veya hidroksil iyonunun iletkenliği kadar
yüksek bir iletkenliğe sahip olmadığından asit-baz reaksiyonlarının dışındaki
reaksiyonlarda iletkenlik değişiklikleri oldukça küçüktür (nadiren ayni
seviyededir). Çökelme reaksiyonlarında ayrıca, çökeleğin çözünürlüğü de bir
sorun kaynağıdır.