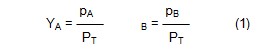İki faz dengeye geldiğinde madde transferi sınırına ulaşılır
ve net madde transferi durur. Yeterli bir üretim hızının gerektiği bir işlemde
denge halinden kaçınılır; çünkü herhangi bir noktadaki kütle transfer hızı, o
noktada dengeden olan ayrılığı belirten yürütme kuvveti ile orantılıdır.
Yürütme kuvvetini değerlendirebilmek, fazlar arasındaki
denge bilgilerine dayanır. Dengeyi kontrol eden değişkenler sıcaklık, basınç ve
konsantrasyondur. Denge verileri tablolar, eşitlikler ve grafiklerde
görülebilir.
BUHAR-SIVI
DENGELERİ
Buhar ve sıvı arasındaki dengede kısmi basınç kavramı
önemlidir. Bir gaz karışımındaki A ve B bileşenlerinin kısmi basınçları pA
ve pB, YA ve YB mol fraksiyonları ile
aşağıdaki bağıntıdadır; PT, karışımın toplam basıncıdır.
İki bileşenli bir karışım için,
şeklinde verilir. Kısmi basınçların toplamı, toplam basınca
eşittir.
Sıvı faz sadece bir madde içerirse, bu maddenin kısmi
basıncı, saf haldeki basıncına eşittir (aynı sıcaklıkta).
Etil eter-aseton karışımının 20 0C deki kısmi
basınç-konsantrasyon eğrileri Şekil-1 de görülmektedir. Eğriler, denge halinde
iki fazın analiz edilmesi ve pA ve pB nin, Denklem(1)
veya (2) ile hesaplanmasıyla çizilmiştir.
Şekil-1: Etil eter-aseton
karışımının 20 0C deki kısmi basınç-konsantrasyon eğrileri
Henry
Kanunu
Düşük konsantrasyonlarda, pA – Xe
grafiği orijinden geçer ve eğrilmeden önce kısa bir mesafede doğru şeklindedir.
Etil eter için bu mesafe Xe = 0 ile Xe> = 0.15
arasındadır. Çözeltide ayrışan elektrolitler dışında, bu davranış geneldir ve
maddelerin seyreltik çözeltilerdeki temel özelliğidir. Kısmı basınç,
eşitliği ile verilir HA = Henry Kanunu sabiti
sıcaklığa, çözücüye ve biraz da basınca bağlı bir sabit, Xe =
çözeltideki A bileşeninin dengedeki mol fraksiyonudur. Bu eşitlik Henry Kanunu
olarak bilinir; değeri ve sabit kaldığı konsantrasyon aralığı sadece deneylerle
saptanabilir.
Rault
Kanunu
Bir çözeltide A nın mol fraksiyonu çok yüksekse (saf maddeye
yakınsa, Xe = 1), kısmi basıncı konsantrasyonu ile orantılıdır.
K = orantı sabitidir. Xe = 1 olduğunda, pA
= PA0, K = PA0 olacağından,
Aynı kural ikili çözeltideki B bileşeni için de geçerlidir.
Denklem(4) ve (5), Rault Kanununun matematiksel ifadesidir:
"bir çözeltideki bir bileşenin kısmi basıncı, saf haldeki buhar basıncı ve
mol fraksiyonunun çarpımına eşittir". Şekil-1 deki noktalı hatlar Rault
Kanununu gösterir. Çözeltideki bileşenlerden biri için Henry Kanununun geçerli
olduğu konsantrasyon bölgesi, diğer bileşen için Rault Kanununa uygunluk gösterir.
Çünkü Henry Kanunu çok seyreltik halleri, Rault Kanunu çok konsantre halleri
tanımlar. Şekil-1 de absis ekseni sağa doğru artan etil eter konsantrasyonunu,
sola doğru artan aseton konsantrasyonunu göstermektedir. Bu durumda aa
aralığında etil eterin mol fraksiyonu çok düşük (Henry Kanunu), asetonunki çok
yüksektir (Rault Kanunu). Keza bb aralığında etil eter Rault Kanununa, aseton
Henry Kanununa uyar.
İdeal
Çözeltiler
Rault Kanunu bazı karışımlarda, tüm konsantrasyon aralığında
(0-1.0) her bileşene uygulanabilir. Bu tip karışımlara "ideal
karışımlar" denir. Kısmi basınç-konsantrasyon eğrileri, Şekil-1 de noktalı
çizgilerle gösterildiği gibi düz hatlar şeklindedir. İdeal çözeltilerde Henry
ve Rault Kanunları birbirine eşittir; bir bileşenin Henry Kanunu sabiti (H),
saf haldeki buhar basıncına (PA0 veya PB0)
eşit olur.
Gerçekte ideal olan çözeltiler çok azdır. İzotop karışımları
idealdir. Ayni tip ve yaklaşık aynı büyüklüklerdeki (bazı homolog
hidrokarbonlar) non-polar moleküller ideal çözelti kanununa yaklaşırlar.
Benzen, toluen, ksilenler, düşük molekül ağırlıklı parafinler karışımı, normal
sıcaklıklarda Rault Kanununa uyarlar. Su, alkol, elektrolitler gibi polar
yapılı bileşikler ideal çözelti kanunundan önemli derecede sapar. İki-bileşenli
bir karışımda bileşenlerden biri ideal kanuna uygunluk gösterdiğinde diğeri de
uyar.
İdeal çözelti kanununda çözelti üzerindeki gaz fazının ideal
gaz olduğu kabul edilmiştir; dolayısıyla bir bileşenin kısmi basıncı (pA,
pB gibi) ideal gaz yorumuna dayanır. Kısmi basınç, taneciklerinin
çözeltiden gaz fazına geçme eğilimini gösterir. Bir çözeltideki A bileşeni,
buharı ile dengededir (buhar-sıvı dengelerine termodinamik bağıntılar
uygulanır).
Denge
Eğrileri ve Kaynama Noktası Diyagramları
A ve B maddelerinden oluşan ikili bir karışımın buhar-sıvı
dengesindeki denge eğrileri ve kaynama noktası diyagramları Şekil-2 de
görülmektedir.
Sabit basınçta A bileşeninin kaynama noktası TA,
B bileşenininki TB dir; A bileşeni daha uçucudur. Sıcaklıklar
ordinat, konsantrasyonlar (mol kesri) apsis olarak verilmiştir. Diyagramda, iki
uçları birleşen iki eğri vardır. Üstteki eğri üzerinde alınan bir Y noktası,
buharın tam T1 sıcaklığında yoğunlaşmaya başlayacağını gösterir. İlk
damlanın konsantrasyonu d noktasıyla tanımlanır; üstteki eğriye "çiğlenme
(dew)-noktası eğrisi" denir. Alttaki eğri üzerindeki X gibi bir nokta ise,
sıvının tam T1 sıcaklığında kaynamaya başlayacağını belirtir. İlk
oluşan buhar kabarcığının konsantrasyonunu e noktasıdır; alttaki eğriye
"kabarcıklaşma (bubble)-noktası eğrisi" denir. X ve Y gibi aynı yatay
doğru üzerinde bulunan herhangi iki nokta, ordinatta belirtilen sıcaklıkta (T1),
dengedeki sıvı ve buharın konsantrasyonlarını gösterir. Bu noktaların (X ve Y)
apsisleri Xe ve Ye dir; Ye, karışımdaki
maddelerden birinin (örneğin A) denge halinde buhar fazındaki mol kesri, Xe
ise ayni maddenin sıvı fazdaki mol kesridir. üstteki eğrinin üzerinde kalan tüm
noktalarda (a gibi), karışım tümüyle buhar halindedir; keza, alttaki eğrinin
altındaki her noktada (b gibi), karışım tümüyle sıvıdır. İki eğri arasındaki
bölgede kalan noktalarda (c gibi), sistem kısmen sıvı, kısmen buhar halindedir.
Konsantrasyonu d olan sıvı karışımı, yavaş yavaş ısıtılarak
T1 sıcaklığına yükseltildiğinde kaynamaya başlar. İlk oluşan buhar
kabarcığının konsantrasyonu Y ile tanımlanır; bu noktanın sıvı eşdeğeri d değil
e dir.
Şekil-2: Kaynama noktası diyagramı
Çünkü X noktasına gelindiğinde hızla buhar oluşumu
gerçekleşir ve buhardaki A bileşeni (kaynama noktası daha düşük), d noktasıyla
tanımlanan sıvıdakinden daha yüksektir; bu bileşim e noktasındaki
konsantrasyona eşittir. Sıcaklığın yükseltilmesiyle X ve Y noktaları da TB
ye doğru kayar; TB de buharlaşan sadece B bileşenidir. Kaynama
noktası ve denge eğrileri çoğunlukla deneyle saptanır.
Karışım Rault Kanununa uyuyorsa, karışımı oluşturan
maddelerin saf haldeki buhar-basıncı verileri bilindiğinde, kaynama-noktası
diyagramı hesapla bulunabilir. Yöntemde kullanılacak eşitlikler aşağıda
verilmiştir. (PT = sabit)
Denklem(6) ve (7) saf bileşenlerin kaynama noktaları
arasındaki birkaç sıcaklıkta çözülerek elde edilen Xe ® T ye, Ye ® T ye karşı grafiğe alınır. Ayrıca Xe
nin Ye ye karşı çizilen grafiği ile de denge eğrisi bulunur.
ÖRNEK
Benzen ve toluenin buhar basınçları aşağıda verilmiştir.
Karışımın Rault kanununa uyduğu kabul ediliyor. 1 atm toplam basınçta,
benzen-toluen sisteminin kaynama noktası ve denge eğrisini çizin.
80.6 - 110.6 0C ler arasında tablodan birkaç
sıcaklık seçilir ve Denklem(6) ve (7) de pA ve pB
değerleri konularak Xe ve Ye hesaplanır. Örneğin,
Azeotropik
karışımlar
Pek çok sistem Rault Kanununa uymaz, buna rağmen bazılarının
kaynama- noktası ve denge eğrileri, kalitatif olarak Şekil-3 ve 4 e benzer.
Yani, kaynama-noktası eğrileri yay (fiyonk) şeklinde, denge eğrileri konkavdır
(içbükey); kabarcıklaşma ve çiğlenme noktaları saf bileşenlerin kaynama
noktaları arasındadır; herhangi bir sıvı karışımla denge halinde bulunan
buhardaki A bileşeni, sıvı karışımdakinden daha fazladır.
Şekil-3 ve 4 deki eğrilere benzemeyen eğriler veren önemli
sistemler vardır. Kloroform-aseton karışımı Şekil-5(a) da, benzen-etanol
karışımı Şekil-5(b) deki gibi kaynama-noktası eğrileri verirler. Şekil-5a da Tb
ile tanımlanan kaynama noktası, bu ikili-karışımın Xa konsantrasyonundaki
kaynama sıcaklığını gösterir; bu değer, karışımdaki iki maddenin saf haldeki
kaynama noktalarından daha yüksek bir sıcaklıktır. Şekil-5(b) de, Xa
konsantrasyonundaki Tb kaynama değeri ise bu ikili- karışımın
kaynadığı en düşük sıcaklıktır ve iki maddenin saf haldeki kaynama
noktalarından daha düşüktür. Bu tip maksimum ve minimum kaynama noktaları
gösteren karışımlara azeotroplar denir. Bir azeotroptan üretilen buharın
bileşimi, elde edildiği sıvınınki ile aynıdır; buhar ve sıvının bileşimi
değişmeden sabit basınçta distillenir. Bu koşullarda sıcaklık ta
değişmeyeceğinden, azeotroplara sabit-kaynama noktalı karışımlar denir. Bir
azeotrop sabit-basınçta yapılan distilasyonla bileşenlerine ayrılamaz. Bu
nedenle bir azeotropu bozmak için toplam basıncın değiştirilmesi, veya üçüncü
bir bileşen ilave edilmesi gerekir.
Kloroform-aseton sisteminin denge eğrileri Şekil-6(a) da,
benzen-etanol sistemininki Şekil-6(b) de görülmektedir.
Şekil-5: Azeotropik sistemler için
kaynama noktası diyagramları; (a) maksimum kaynamalı azeotrop
(kloroform-aseton), (b) minimum kaynamalı azeotrop (benzen-aseton) sistemleri
Relatif
Uçuculuk
İkili-sistemlerdeki denge ilişkileri relatif uçuculuk (aAB) terimiyle tanımlanır.
Verilen bir sıcaklıkta PA0 ve PB0
sabittir, dolayısıyla ideal sistemlerle sabit-sıcaklıktaki işlemler için aAB = sabittir. Sabit basınçtaki
ideal sistemlerin çoğunda aAB sıcaklıkla çok az değişir ve
sabit kabul edilebilir.
İdeal olmayan karışımlar için aAB,
bileşimle değişir. Azetropik bir karışımda YA = XA, YB
= XB olduğundan, aAB
= 1 dir. aAB = 1, karışımın
distilasyonla ayrılamayacağını, aAB
=1.0 – 1.1 arasındaki değerler, karışımın ayrılabileceğini, fakat zor olduğunu
gösterir. aAB nin
yükselmesi, ayrılma işleminin kolaylaştığını belirtir.
Çok
Bileşenli Karışımlar
İkiden fazla bileşen içeren karışımlar için buhar-sıvı
dengeleri basit grafiklerle tanımlanamaz; özellikle azeotropların (ideallikten
sapma) bulunduğu hallerde. Bazı durumlarda, herbir bileşenin denge
özelliklerinden çok bileşenli dengeler hesaplanabilir. Yöntem "K (dağılım)
faktörü" denilen kavrama dayanır:
Yei ve Xei, sırasıyla, buhar ve sıvı
fazlarındaki i bileşeninin buhar ve sıvı denge mol kesirleri, Ki i
bileşenin K faktörüdür. Ki sıcaklığa, basınca ve sıvı fazın bileşimine
bağlıdır. Bazı özel durumlarda, örneğin orta basınçlarda düşük molekül ağırlıklı
hidrokarbon karışımları gibi, K değeri bileşime bağlı olmayıp, sadece sıcaklık
ve basınca bağlıdır. (Hidrokarbonların K değerleri Ek-19 daki nomogramlarla gösterilir;
sabit basınçtaki K = Y / X - sıcaklık eğrilerine örnekler, Ek-20 de
verilmiştir.)
Çok bileşenli karışımların denge hesaplamalarında K
değerleri kullanılır (belirtilen sıcaklık ve basınçta). Mol kesri tanımına
göre,
Σ işareti,
sistemdeki tüm bileşenleri kapsar. Sıvı fazın bileşimi bilindiğinde, yukarıdaki
eşitlikten buhar fazın, bu fazın bileşimi bilindiğinde sıvı fazın bileşimi hesaplanabilir.
Hesaplarda sıcaklık (veya basınç) sabittir; yukarıdaki eşitlik gerçekleşinceye
kadar, denemeyle diğerine tahmini değerler verilir.
Gazların
Çözünürlüğü
Gaz-absorbsiyon işlemlerinde denge, uçucu olmayan
absorblayıcı bir sıvı ile gaz arasında kurulur. Sıvı içinde çözünen gaz,
karışımından, sıvıda da çözünmeyen çok miktardaki bir taşıyıcı gaz ile çekilir
(uzaklaştırılır). Sıcaklık, basınç ve bir fazdaki madde konsantrasyonu bağımsız
değişkenlerdir. Sıvı fazdaki madde mol kesri Xe nin, buhar fazındaki
mol kesri Ye ye karşı grafiğe alınmasıyla denge eğrisi elde edilir.
Bu eğrinin elde edilebileceği veriler tablolarda bulunabilir; tablolarda,
maddenin kısmi basıncı, pA (mmHg)-sıvıdaki konsantrasyonu, cA
(lb madde/100 lb veya g madde/100 g çözücü) verilir.
Henry Kanununa uygun gazlar için (oksijen, karbon dioksit,
hava gibi) Henry Kanunu sabiti HA, Denklem(3) ile tanımlanır.
Burada pA = maddenin kısmi basıncı (mm Hg), cA
= maddenin sıvıdaki konsantrasyonudur (lb madde / 100 lb veya g madde / 100 g
çözücü).
HA’ yı, mol kesirleri cinsinde denge
eğrisinin eğimi olan m ye çevirmek için aşağıdaki eşitlik kullanılır.
Denklemdeki (1 – Xe) değeri, Henry Kanunu sadece
seyreltik çözeltilere uygulandığından 1 kabul edilir. Bu durumda, Henry
Kanununa uyan sistemler için Ye ve Xe arasındaki denge
bağıntısı, orijinden geçen ve eğimi m olan düz bir doğrudur. Çözünürlüğü daha
fazla olan gazlar için kısmi basınçları konsantrasyon ve sıcaklığın fonksiyonu
olarak gösteren verilere gereksinim vardır.
Şekil-7 ve 8, sudaki amonyak ve sudaki SO2 nin
verilerine göre çizilmiş eğrileri gösterir. Heriki eğri de pA – cA
ya göre çizilmiştir. Xe – Ye eğrisi üzerindeki noktalar,
bu verilerden hesaplanabilir.
Şekil-7: Amonyağın sudaki çözünürlüğü
Şekil-8: Kükürt dioksitin sulu
çözeltisi üzerindeki kısmi basıncı
ÖRNEK
Kükürt dioksit (A) – hava – su (B) sisteminin mol fraksiyonları birimleri ile, Şekil-8 deki konsantrasyon aralığında denge eğrisini çizin. P = 1 atm, T = 30 0C dir. Mol fraksiyonları birimleri Xe ve Ye, MA = 64, MB = 18 dir.
Kükürt dioksit (A) – hava – su (B) sisteminin mol fraksiyonları birimleri ile, Şekil-8 deki konsantrasyon aralığında denge eğrisini çizin. P = 1 atm, T = 30 0C dir. Mol fraksiyonları birimleri Xe ve Ye, MA = 64, MB = 18 dir.
Şekil-8 deki eğriden cA = 1, 2, 3, 4, 5, 6 g SO2
/ 100 g su değerlerine karşı pA değerleri okunur ve yukarıdaki
eşitliklerde yerine konularak Ye ve Xe mol kesirleri
hesaplanır. Bu değerler ile Ye – Xe denge eğrisi çizilir
(Şekil-9).
Şekil-9: Kükürt dioksitin 1 atmosfer basınç ve 30 0C deki
denge eğrisi
Şekil-10: Hava – su sisteminin 1 atmosfer basınçtaki denge eğrisi
Nem
Giderme İşleminde Denge
Nemlendirme ve nem giderme işlemlerinde sıvı faz tek saf
bileşendir. Madenin gaz fazındaki denge kısmi basıncı, sisteminin toplam
basıncı sabit tutulduğunda, sadece sıcaklığın fonksiyonudur. Orta basınçlarda
ise, denge kısmi basıncı toplam basınçtan bağımsızdır ve sıvının buhar
basıncına eşittir. Gaz fazında denge kısmi basıncı, Dalton Kanunu uygulanarak
denge mol fraksiyonuna (Ye) çevrilebilir. Sıvı saf olduğundan Xe
= 1 dir. Denge verileri çoğu kez Ye – T şeklinde verilir.
Hava-su sistemi için 1 atm deki denge eğrisi Şekil-10 da görülmektedir.
Gaz fazındaki madde konsantrasyonuna bazan "nem = H" adı verilir
(hava-su sisteminde olduğu gibi).
Entalpi-Konsantrasyon
Diagramları
Absorbsiyon ve distilasyon problemlerinin çoğunda iç
ısıların, karışma ısılarının ve karışımı oluşturan bileşenlerin hissedilir
ısılarının dikkate alınması gerekir. İkili- sistemler için bu değerler ve denge
verileri bir entalpi-konsantrasyon diyagramı üzerinde gösterilir. Böyle bir
diyagram kütle veya mol bazına göre hazırlanır.
Amonyak-su karışımları için çizilmiş bir entalpi-
konsantrasyon diagramı Şekil-11 de görülmektedir. Bu şekil, 10 atm sabit
basınçta uygulanır. Apsis, bir amonyak-su karışımındaki amonyağın (uçucu
bileşen) kütle kesri, ordinat karışımın öz entalpisi (Btu/lb) dir. Entalpiler
seçilen standart halleri gösterir. Şekildeki saf suyun standart hali 32 0F
(0 0C) ve 1 atm dir. Sabit basınçta 1 lb doygun sıvının veya doygun
buharın entalpisi sadece kaynama noktasına bağlı olduğundan (kabarcıklanma
noktası da sadece konsantrasyona bağlı olduğundan), entalpi değerleri
konsantrasyonun fonksiyonu olarak grafiğe alınabilir. Doygun sıvının ve doygun
buharın öz entalpilerini gösteren eğriler Şekil-11 de verilmiştir.
Doygun buharın öz entalpisi HY, doygun sıvınınki
HX (Btu/lb) ile gösterilsin. Bu durumda HX – X değerleri
ile doygun sıvının, HY – Y değerleri ile de doygun buharın eğrileri
çizilir. A bileşeninin sıvıdaki ve buhardaki kütle kesirlerini gösteren X ve Y
değerleri diyagramın apsisine alınmıştır. Entalpi-konsantrasyon diyagramına HX
diyagramı da denir. Doygun buhar eğrisinin üstünde kalan tüm noktalar aşırı-ısınmış
(kızgın) buharı, sıvı eğrisinin altında kalanlar kabarcıklanma noktalarının
altındaki sıvıları tanımlar; iki eğri arasındaki tüm noktalar ise doygun-sıvı
ve doygun-buhar karışımlarına aittir. Sıvı bölgedeki izotermler, konsantrasyon
ve sıcaklığın fonksiyonu olarak, sıvı karışımların entalpilerini verir.
Sıvı ve buhar fazları arasındaki denge, doygun-sıvı hattı ve
doygun-buhar hattını birleştiren düz çizgilerle gösterilir. Bu düz çizgilere
"tie bağları(düğüm hatlar)ı" denir. Herhangi bir tie bağının
uçlarının apsisleri Xe ve Ye değerlerini tanımlar; bunlar
(Xe, Ye), denge eğrisindeki bir noktanın
koordinatlarıdır. Her tie bağı, karışık-faz bölgesinde bir izotermdir. Şekil-11
deki tie bağları, Şekil-2 deki gibi bir kaynama-noktası diyagramının kabarcıklaşma-noktası
ve çiğlenme-noktası arasındaki yatay hatların karşılığıdır.
Şekil-11: Amonyak-su karışımlar,
entalpi-konsantrasyon diyagramı (p = 10 atm.)
Tie bağlarının sayısı sonsuzdur; Şekil-11 de birkaç tanesi
gösterilmiştir. Diğer tie bağlarının elde edilmesi için bir interpolasyon
yapılması gerekir; veya, daha doğru çizimler için, Şekil-12a da görülen yöntem
kullanılır. Herbir tie bağı için Şekilde a ile gösterilen bir nokta elde
edilir. Bunun için, tie bağının alt ucundan dik, üst ucundan yatay birer doğru
çizilir; doğruların kesiştiği nokta a noktasıdır. Çok sayıda tie bağı için bu
şekilde saptanan noktalarla "yardımcı eğri" adı verilen eğri elde
edilir. Böylece istenilen bir Xe veya Ye değerine ait tie
bağı önceden hazırlanan bu yardımcı eğri yoluyla kolaylıkla bulunabilir. Te
bağlarının elde edilmesinde bir başka güzel yöntem de, entalpi-bileşim
diagramının hemen üstüne bir yardımcı sıcaklık-bileşim diagramı çizme yöntemidir
(Şekil-12b).
Şekil-12: Tie bağı çizim yöntemleri;
(a) yardımcı eğri, (b) sıcaklık-bileşim diyagramı, yöntemleri
SIVI-SIVI
DENGELERİ
Sıvı ekstraksiyonunda faz dengeleri, A maddesinin,
birbirinde karışmayan veya kısmen karışan B ve S gibi iki sıvı arasındaki dağılımını
gösterir. Burada iki hal söz konusudur; birincisi, A maddesi bulunduğu durumda
bile, B ve S nin birbirindeki çözünürlüğünün ihmal edildiği; ikincisi, bu
çözünürlüğün dikkate alındığı durumlardır.
Dengeye ulaşıldığında B fazı (+ bir miktar çözünmüş A) S, S
fazı (+ bir miktar çözünmüş A) B maddesi içermez; iki fazda bulunan A maddeleri
arasında basit bir denge kurulmuştur. Bu durum gaz absorbsiyon işlemine benzer
ve denge eğrisi Xe – Ye eğrisi şeklindedir. Seyreltik
çözeltilerde Henry Kanunu geçerlidir.
Bazı sistemlerde denge eğrisi geniş bir konsantrasyon
aralığında düz doğru şeklindedir. Gazların sıvılarda çözünürlüğündeki gibi,
denge sıcaklığa bağlıdır; fakat gaz-sıvı dengelerinin tersine sıvı-sıvı
dengeleri basınca bağlı değildir.
Üçgen Koordinatlar
Seyreltici ve çözücünün birbirindeki çözünürlüğü önemli
olduğunda, çözünürlük ve denge ilişkisi üçgen koordinatlar üzerinde gösterilir.
Bu yöntemde üçlü bir karışımın bileşimi, Şekil-13 te
görüldüğü gibi, bir eşkenar üçgenin içindeki bir nokta ile tanımlanır. Üçgen
diyagramın bazı önemli özellikleri vardır. Üç bileşenin konsantrasyonları, XA,
XB, XS ve YA, YB, YS ile
gösterildiğinde,
XA + XB + XS
= 1
YA + YB + YS
= 1
Şekil-13: Üçgen koordinatlar
Şekil-14: Aseton-MIK-su sistemi, 25 0C' de
Bu diyagramlarda mol kesirleri veya kütle kesirleri
kullanılabilir; kütle kesirleri kullanımı daha yaygındır. Eşkenar bir üçgenin
içindeki bir noktadan kenarlara çizilen dik doğruların uzunlukları toplamı,
üçgenin yüksekliğine eşittir (geometrik kural). Buna göre üçlü bir karışımı
tanımlayan üçgenin yüksekliği, 1 birime eşit olur. M noktasından kenarlara
çizilen dik doğruların toplamı 1 birim olacağına göre, doğruların uzunlukları
kıyaslandığında, %20 A maddesi (XA = 0.2), %30 B maddesi (XB
= 0.3), %50 S maddesinin (XS = 0.5) bulunduğu, dolayısıyla XA
+ XB + XS = 1 olduğu görülür.
Üçgenin bir kenarı iki-bileşenli karışımları tanımlar; N
noktası %80 A, %2 0B maddesi içerir, S yoktur.
Çözücü ve
Seyrelticinin Kısmen Karıştığı Halde Sıvı-Sıvı Dengesi
Aseton-metil izobütil keton (MIK)-su sisteminde 25 0C
deki dengeyi tanımlayan üçgen diyagram, Şekil-14 de görülmektedir. MIK çözücü,
aseton sudan ekstrakt edilecek madde, su seyrelticidir.
MIK, suda %2 kadar çözünür. Suyun MIK daki çözünürlüğü de %2
kadardır. Bu durum Şekil-14 teki B ve A noktalarıyla gösterilmiştir A ve B
noktaları arasındaki herhangi bir MIK-su konsantrasyonundaki karışım iki tabaka
içerir.
MIK ve su karışımına aseton ilave edildiğinde, aseton
tabakalar arasında dağılır ve tabakaların bileşimi iki çözünürlük eğrisiyle
tanımlanır: (1) su tabakası veya rafinat fazı, (2) MIK tabakası veya ekstrakt
fazı. BDE hattı doygun su tabakasının bileşimini, ACE hattı doygun MIK
tabakasını gösterir. Karışımın toplam aseton içeriği arttığında, her iki
fazdaki aseton konsantrasyonu da artacağından, çözünürlük eğrileri birbirine
yaklaşır. İki faz E noktasında birbirinin aynısı olur. Her iki eğri üzerindeki
bu noktaya "eş çözünürlük = bükülme (plait) noktası" denir.
Kubbe-şeklindeki ABEDC eğrisinin altındaki alan, dengede
iki-sıvı tabaka oluşturan tüm karışımların bileşimlerini gösterir. Kubbenin
dışında kalan bütün noktalar tek-fazlı karışımlara aittir. Örneğin M noktası
%70 aseton, %20 MIK, %10 sudan oluşan homojen bir karışımı tanımlar.
Entalpi-konsantrasyon diyagramlarında olduğu gibi, üçgen
diyagramlardaki dengeler de tie bağlarıyla gösterilir. Bunlar, iki çözünürlük
eğrisi üzerindeki noktaları birleştiren düz hatlardır. Bir tie bağının uçları,
dengede, iki fazın noktalarını verir. Eş çözünürlük noktasına yaklaşıldıkça tie
bağlarının boyu kısalır ve eş çözünürlük noktasında sıfır olur.
Kubbe içindeki her nokta bir tie bağı üzerinde bulunur.
Bilinen tie bağları arasında interpolasyon için çeşitli grafik yöntemler
vardır. Diyagramı çizgilerle karalamamak için bir dağılım eğrisi çizilir. Bunun
için, YA = bir fazdaki aseton konsantrasyonunu, XA =
diğer fazdaki aseton konsantrasyonunu göstermek üzere, bir YA – XA
eğrisi çizilir. Bu eğriden tie bağı verileri elde edilir. Dağılım eğrisi, X = Y
köşegeni üzerinde, eş çözünürlük noktası konsantrasyonunda sonlanır.
Bu eğri, distilasyon ve absorbsiyondaki XY eğrisine benzer.
Aseton-MIK-su sistemi için çizilmiş böyle bir eğri Şekil-15 te görülmektedir.
Bir fazdaki aseton konsantrasyonu bilindiğinde tie
bağlarından yararlanılarak, dağılım eğrisinden diğer fazdaki aseton
konsantrasyonu bulunur.
GAZ - KATI VE GAZ - SIVI DENGELERİ
Akışkan bir faz (sıvı veya gaz olabilir) ve bir katı
arasındaki denge, buhar-sıvı veya sıvı-sıvı dengelerinden çok daha karmaşıktır.
Dağılım ilişkileri sıcaklığa ve sistemdeki bileşenlerin kimyasal yapısına bağlı
olduğu gibi, katının fiziksel şeklinden, hazırlanma yönteminden ve geçmişinden
de etkilenir. Birbirine benzer sistemler çok farklı sonuçlar verebilir.
Sıvı-katı dengelerini tanımlayan teoriler sınırlıdır ve deneysel verilerle
doğrulanması gerekir.
Katı Ekstraksiyonu (Leaching)
Katı ekstraksiyonunda iki durum bilinmelidir: (1) Katı,
fazla miktarda bir sıvı çözücüyle etkileştiğinde, içindeki çözünebilen kısmın
(katı) tümü sıvıda çözünür; dengede, çözelti içerdiği katı ile doygun halde
değildir ve aynı bileşimde bir miktar çözelti katı faz içinde kalır. (2) Çözücü
yeterli miktarda değilse katı fazdan, çözebileceğinden daha az çözünebilen
madde ekstrakt eder; bu durumda ise bir kısım madde hala katı faz içinde kalır,
fakat sıvı faz doygun haldedir.
Kristalizasyon
Kristalizasyon işleminde, ana-sıvı doygun hale geldiğinde
dengeye ulaşır. Çözünürlük verileri standart tablolarda bulunur. Çözünürlüğü
sıcaklığın fonksiyonu olarak veren tipik eğriler Şekil-16 da görülmektedir. Pek
çok madde şekildeki (1) eğrisi gibi bir çözünürlük gösterir; çözünürlük,
sıcaklıkla az veya çok hızla artar. (2) Eğrisine uyan madde sayısı azdır;
bunların çözünürlüğü sıcaklıkla çok az değişir. "Ters çözünürlük
eğrisi" denilen (3) deki eğriye göre çözünmede, sıcaklığın artması
çözünürlüğü azaltır.
Kurutma
Kurutmada, bir katı ve nemli hava (veya nemli gaz)
arasındaki denge ilişkisi önemlidir. Şekil-17 de, hava-su-kağıt hamuru
sisteminin 25 0C deki denge bağıntısı görülmektedir; nem içeriği
molal birimlerle verilmiştir. Katılar için nem dengeleri, daha çok, hava veya
gazın relatif nemi ve katının nem içeriği (lb su/100 lb kuru-katı) arasındaki
bağıntı şeklinde verilir.
Şekil-18 de bazı örnekler görülmektedir. Apsisler, lb su/lb
kuru hava birimine dönüştürülebilir.
Denge Nemi ve Serbest Nem:
Islak bir katı, kendinden daha az nemli havayla temas
ettirildiğinde nem-denge eğrisinde görüldüğü gibi, nem kaybeder ve hava ile
dengeye gelinceye kadar kurur; havanın ıslak katıdan daha fazla nemli olması
durumuna ise, dengeye gelinceye kadar havadan nem absorblar. Bir kurutucuya
giren hava nadiren tam kurudur, çoğu kez biraz nemlidir ve belirli bir relatif
neme sahiptir. Kurutucudan çıkan katının nem içeriği giren havanın nemini
karşılayan denge-neminden daha az olamaz. Giriş havasının içerdiği ve katıdan
uzaklaştırılamayan suya "denge- nemi" denir.
Katının toplam-suyu ve denge-nemi arasındaki fark
"serbest su (nem)" olarak bilinir. Bu tanımlamaya göre XT
= toplam-nem, X* = denge-nemi ise,
serbest nem X = XT – X* dir. Kurutma hesaplarında daha çok X
değerleri kullanılır.
**************
EKLER
EK 19. HAFİF HİDROKARBON SİSTEMLERDE DAĞILIM KATSATILARI,
K, DEPRİESTER GRAFİKLERİ (I)
Denge verilerinin saptanmasında kullanılan metotlardan biri
de dağılım katsayısı veya K değerinin kullanılmasıdır (ek 19, düşük sıcaklık aralığı; ek 20, yüksek sıcaklık aralığı). KA
= YA / XA
Dağılım katsayısı K, sıcaklık, basınç ve bileşime bağlıdır;
ancak az sayıdaki bazı sistemler için K değeri bileşimden soyutlanabilir; böyle
hallerde problem büyük ölçüde basitleşir. KA = K (T, p). DePriester
grafiklerinde verilen K değerleri basınç ve sıcaklığa bağlıdır.
DePriester grafiklerinden bir bileşiğin kaynama noktası
sıcaklığı ve basıncı doğrudan okunabilir. Bir karışımdaki bileşenlerden
hangisinin daha uçucu olduğu saptanabilir; daha uçucu bileşenin kaynama noktası
daha düşüktür. Saf bir madde için K = 1 dir.
Soru:
p = 3000 ve p = 1500 kPa basınçlarda etilenin kaynama
noktası kaçtır?
Cevap:
DePriester grafiğinde etilen eğrisi üzerindeki K = 1 değeri
ile basınç skalasında p = 435 psia noktasını birleştiren doğrunun sıcaklık
skalasını kestiği nokta etilenin belirtilen basınçtaki kaynama noktasıdır. Aynı
işlem 217.5 psia değeri için tekrarlanarak, bu basınçtaki kaynama noktası
okunur.
DePriester grafikleri
(I): düşük sıcaklık aralığı
EK 20. HAFİF HİDROKARBON SİSTEMLERDE DAĞILIM KATSATILARI,
K, DEPRİESTER GRAFİKLERİ (II)
Soru:
Etilen, n-pentan ve n-heptandan oluşan bir karışım T = 120 0C
sıcaklık ve p = 1500 kPa basınçtadır; karışımdaki bileşenlerin K değerleri
nedir?
1 Pa = 9.8692 × 10−6 atm = 145.04 × 10−6
psia; 1 atm = 101 325 Pa = 1 atm = 14.696 psia; 1 psia = 6 894.76 Pa = 68.046 ×
10−3 atm = 1 lbf/in2 psia
Cevap:
T = 120 0C (T = 248 0F) p = 1500 kPa (= 217.5 psia, 14.8 atm)
DePriester grafiklerinde sıcaklık ve basınç skalalarında, T
ve p değerlerini birleştiren doğrunun, etilen, n-pentan ve n-heptan eğrilerini
kestiği noktalar belirtilen sıcaklık ve basınçtaki K değerleridir.
K (etilen): 8.5
K (n-pentan): 0.64 K
(n-heptan): 0.17
Soru:
Bu K değerlerine göre, karışımdaki bileşenlerden hangisi
daha uçucudur?
Cevap:
DePriester grafiklerinden, K = 1 için herbir bileşenin
belirtilen basınçtaki sıcaklıkları okunur; bu değerler kaynama noktalarıdır. KA
= YA / XA
etilen (ek 19: K = 8.5, T 0C
(kaynama noktası) = -35.5 (-31.9 0F)
n-pentan: K = 0.64, T 0C
(kaynama noktası) = 153 (307.4 0F)
n-heptan: K = 0.17, T 0C
(kaynama noktası) = 204 (400 0F)
Bu değerlere göre uçuculuklar etilen>n-pentan>n-heptan
sırasını izler.
DePriester grafikleri
(II); yüksek sıcaklık aralığı
GERİ (proje çalışmaları)