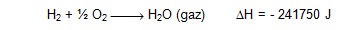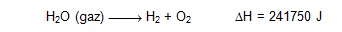Termodinamiğin birinci kanunu, mekanik enerjinin korunması
ilkesinin genişletilmiş bir halidir. Enerjinin bir sistemden diğerine transfer
edilmesi iş ve ısı oluşmasıyla sağlanır. İki sistem arasında ısıl temas sonucu
bir sıcaklık farkı oluşuyorsa, enerji bir sistemden diğerine ısı şeklinde
aktarılmıştır. Açık sistemler arasında da sistemden sisteme madde taşınmasıyla
ısı transferi yapılabilir. Ancak "bir sistemin ısısı" veya
"işi" yerine "bir sistemin enerjisi"nden bahsedilir.
Termodinamiğin
Birinci Kanunu
Enerjinin korunumu ve ısının mekanik eşdeğeri konularındaki
çalışmalar 18. yüzyılın sonlarında başlamıştır. Araştırmacılardan Julius Robert
Mayer, araştırmalarını ısının kinetik ve potansiyel enerjiye eşdeğerliği
üzerinde yoğunlaştırmıştır. Yayınladığı çalışmasında (1842), "bir
ağırlığın 365 metre yükseklikten düşmesi, aynı ağırlıktaki suyun 0 0C
den 1 0C ye ısıtılmasına eşdeğer enerjide bir olaydır"der. Bu
yorum, mekanik enerji birimleriyle ısıl birimlerin ilişkili olduğunu açıklar.
Çevirme faktörüne ısının mekanik eşdeğeri (J) denir.
J’ nin birimi joule/kalori dir. 1g ağırlığı 365m kaldırmak
için 365x102x981 erg, veya 3.58 J işe gereksinim vardır. 1g suyun sıcaklığının
0 0C den 1 0C’ye yükseltilmesi için de 1.0087 kal gerekir. Bu durumda Mayer'in
hesapladığı J = 3.58/1.0087 = 3.56 J/kal dir. J’nin kabul edilmiş değerine (J =
4.148 J/kal) en yakın değeri yine Joule hesaplamıştır (J = 4.154 kal).
Joule İşi
James Prescott Joule yayınladığı çalışmasında (1840)
elektrik akımının ısıtma etkisini açıklayan Joule kanununu ileri sürmüştür:
"voltaik bir elektrik akımı bir metalik iletken boyunca ilerlediğinde,
belirli bir zaman içinde açığa çıkan ısı, iletkenin direnci ve elektrik
şiddetinin (akım) karesi çarpımı ile orantılıdır".
Joule ısısı, elektrik akımını taşıyan malzemelerin yarattığı
sürtünme ısısı olarak düşünülebilir. Joule, yaptığı çok çeşitli deneylerle
"ısının mekanik eşdeğerini" saptamıştır (1849); aldığı sonuçlara
göre, 1lb suyun sıcaklığını 1 0F ısıtmak için gerekli ısı , 772 foot
pound (ft lb) işe eşdeğerdir; Joule işi, J =4.154 J/kal olur.
Birinci Kanunun
Formüllendirilmesi
Mayer ve Joule'ün çalışmaları enerjinin korunması
gerektiğini göstermiştir. Helmholtz'un çalışmalarında ise enerjinin
korunmasının temel bir kanun olduğu ve tüm doğal olaylara uygulanabileceği
belirtilmiştir. Bir sistemin "iç enerjisi"ni U fonksiyonu ile
tanımlayalım. Sınırlarından hiç bir kütle transferi olmayan sisteme
"kapalı sistem" denir. Böyle bir sistem A halinden B haline geçsin;
sistemin çevresi ile etkileşimi, sadece sisteme q ısısının transferi veya
sistemde yapılan w işi ise, sistemin iç enerjisindeki değişme (DU),
Termodinamiğin birinci kanununa göre bu enerji farkı (DU), sistemin ilk ve son hallerine bağlı
olup, haller arasında izlenen yola göre değişmez. Sistem A dan B ye değişik
yollardan gidebilir ve yol boyunca q ve w yolun şekline göre çok çeşitli
değerler alır, fakat sonuçtaki q + w = DU toplamı daima aynı değerdedir, yani
sabittir. Bu yorum gerçek olmasaydı, kapalı bir sistemde önce bir yoldan A dan
B ye gidilir, sonra B den başka bir yol izlenerek tekrar A ya gelinir ve bir
enerji farkı elde edilebilirdi; bu durum enerjinin korunumu ilkesine aykırıdır.
Yukarıdaki (3)denklemi, termodinamiğin birinci kanununun matematiksel
ifadesidir. Diferensiyal bir değişiklik için dU,
Birinci kanuna göre, çevresiyle ilişkisi olmadan çevrimsel
bir işlemle çalışarak sürekli iş verebilen bir makine yapılamaz. A dan B ye ve
tekrar B den A ya dönen çevrimsel bir işlem düşünüldüğünde aşağıdaki eşitlikler
geçerlidir.
İç Enerjinin Doğası
Önceki bölümde incelenen denge sisteminin, yerçekimi ve
elektromagnetik alanın etkisinde olmadığı varsayılmıştı. Bu koşullar altında iç
enerji U daki değişiklikler, sistemin potansiyel enerjisindeki ve ısı şeklinde
transfer edilen enerjisindeki değişiklikleri içerir. Potansiyel enerji
değişiklikleri, kimyasal reaksiyonlar sırasında yeniden oluşan moleküler
konfigürasyonlar nedeniyle olan enerji değişikliklerini de kapsar. Sistem
hareket halindeyse U ya kinetik enerji, elektromagnetik alanların etkisinde
olduğunda ise ayrıca elektromagnetik enerji de eklenir. Keza, çekim
kuvvetlerinin varlığında, Birinci Kanun uygulanmadan önce U ya çekim alanı enerjisinin
de ilave edilmesi gerekir.
Kütle ve enerjinin birbirine dönüşebildiğini biliyoruz. Bu
nedenle Birinci Kanun'a, kütle-enerji korunumu kanunu da denebilir. Kimyasal
reaksiyonlarda enerji değişiklikleri ile ilişkili kütle değişiklikleri çok
küçük olduğundan, sıradan kimyasal termodinamiklerde kütle dikkate alınmaz.
Isının Termodinamik
Anlatımı
Isıyı daha iyi tarif edebilmek için Şekil-1 deki sistemi
inceleyelim. Şekilde I ile gösterilen sistem, II ile gösterilen çevreden
adyabatik bir duvarla ayrılmıştır. "Adyabatik duvar", iki sistemin
birbiriyle ısıl dengeye ulaşmasına olanak vermeyen bir engel olarak tarif
edilir.
Şekil-1: Çevresinden (II) adyabatik bir duvarla ayrılan bir sistem (I)
Sistem I, yapılan basınç artırıldığında başlangıçtaki A
halinden sıkıştırılmış B haline geçer; sistemde yapılan adyabatik iş wad
dır. Bu durumda Birinci Kanuna göre, "A halinden B haline geçen bir
sistemde yapılan iş, sadece ilk ve son hallere bağlıdır ve bir hal fonksiyonu
olan iç enerjideki (U) artışa eşittir".
Sistemin yine A halinde olduğunu, fakat
"diatermik" bir duvarla çevrildiğini varsayalım. Böyle bir duvar ayrı
sistemlerin ısıl dengeye gelmesine olanak verir. Bu durumdaki sistem A
halinden, sonsuz sayıdaki yollardan birini izleyerek B haline geçer
(nonadyabatik yollar). Sistemde yapılan iş w dir. wad- w farkı, A
dan B ye geçişte sisteme transfer edilen ısıdır.
Buna göre bir işlemde transfer edilen q ısısı, sistemde A
dan B ye giderken yapılan adyabatik iş ile nonadyabatik bir iş arasındaki farka
eşittir.
Adyabatik ve İzotermal
İşlemler (Prosesler)
Laboratuvar çalışmalarında ve termodinamik yorumlarda iki
çeşit işlem vardır. Sabit sıcaklıktaki işleme "izotermal işlem"
denir; yani, T = sabit, dT = 0 dır. İzotermal koşullarda çalışmak için
reaksiyonlar çoğunlukla bir termostatta yapılır. Diğeri adyabatik işlemdir, bu
durumda sisteme ne ısı verilir ne de ısı alınır; yani, q=0 dır. Diferensiyal
bir adyabatik işlem için dq = 0 olur; bu durumda dU = dw dir. Hacimdeki
adyabatik tersinir değişme durumunda dU = - P dV eşitliği gerçekleşir.
Adyabatik tersinmez bir değişiklik ise dU = -Pex dV formülüyle
verilir. Adyabatik koşullara, sistemin çok iyi ısıl izolasyonu ile ulaşılır.
Isı iletimine karşı en iyi izolatör yüksek vakumdur. Çok iyi parlatılmış
duvarlar, ışıma ile ısı kaybını en aza indirir; Dewar kapları bu amaca uygun
malzemedir.
Entalpi
Sabit hacimde yapılan bir işlem sırasında mekanik bir iş
yapılmaz; V = sabit, dV = 0, w = 0 dır; bu durumda enerjideki artış absorblanan
ısıya eşittir.
Atmosferik basınçta yapılan deneylerde olduğu gibi basınç
sabitse, P DV işinden başka bir iş
yapılmaz.
Eşitlikteki qp, sabit basınçta absorblanan
ısıdır. Buna göre, "entalpi, H" adı verilen yeni bir fonksiyon
tanımlanabilir. Entalpideki artış, P DV
işinden başka bir iş yapılmadığı durumda, sabit basınçta absorblanan ısıya
eşittir.
Entalpi(H) de, enerji(U) veya sıcaklık gibi sistemin sadece
bir hal fonksiyonudur ve sistemin bulunduğu hale geliş yoluna bağlı değildir.
Bu yorum, Denklem(10) daki U, P, V nin hal fonksiyonları olmasından dolayıdır.
Isı Kapasiteleri
Isı kapasiteleri ya sabit hacimde veya sabit basınçta
ölçülür. Önceki bölümde görülen Denklem (38),
eşitlikleriyle verilir. Sabit basınçtaki ısı kapasitesi CP
çoğunlukla sabit hacimdeki ısı kapasitesi CV den büyüktür. Çünkü
sabit basınçta, bir maddeye verilen ısının bir kısmı onu genişletme işinde
harcanır, oysa sabit hacimde verilen ısının tamamı sıcaklık yükselmesinde
kullanılır. CP – CV farkı aşağıdaki gibi çıkarılır.
olduğundan, dU denklemindeki dV yerine konulup katsayılar
kıyaslanarak aşağıdaki eşitlik elde edilir.
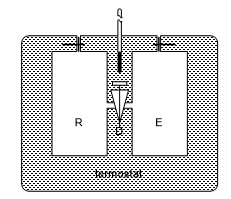
Joule Deneyi
Joule deneyi, serbest olarak genişleyen havanın sıcaklığında
bir değişiklik olmadığını ve mekanik güç oluşmadığını gösterir. Deney Şekil-2
deki sistemle yapılır. R ve E bakır kapları D tapası ile birbirinden
ayrılmıştır. R kabında 22 atmosfer basınçlı hava bulunur, E kabının havası bir
vakum pompası ile boşaltılmıştır. Kaplar, içinde su bulunan bir termostata
konulur. Termostattaki su iyice karıştırılarak bir termometre ile sıcaklığı
izlenir. D tapası açılır ve R deki basınçlı gaz, dengeye ulaşıncaya kadar E
kabına yayılır. Termostattaki suyun sıcaklığı ölçülür; sıcaklığın başlangıçtaki
değerle aynı olduğu görülür.
Bu deneydeki gaz genişlemesi tipik bir tersinmez işlemdir.
Deney süresince birbirine eşit olmayan basınç ve sıcaklıklarla karşılaşılır,
ancak sistem dengeye geldiğinde bu değerler sabitleşir.
Gaz tarafından çevreye veya çevreden gaza herhangi bir iş
yapılmadığından ve çevre suyu ile ısı transferi olmadığından gazın iç enerjisi
değişmez. Bu nedenle dU = 0 dır. Deney sonucuna göre de dT = 0 dır. Joule, iç
enerjinin sadece sıcaklığa bağlı olduğunu, hacme göre değişmediğini ileri
sürmüştür. Bu yorum matematiksel terimlerle gösterilebilir.
Şekil-2: Joule deneyi
Joule - Thomson
Deneyi
William Thomson ve Joule beraber çalışarak daha hassas
sonuçlar elde etmişler ve gazın basıncının sıcaklıkla değişimini inceleyen bir
formül çıkarmışlardır (1852-1862). On yıl süren çalışmalarını Şekil-3 te
görülen sistemle yapmışlardır. Düşüncelerine göre, yüksek basınçtaki bir gaz
poröz (gözenekli) bir engelden geçerek düşük basınçlı tarafa akar. Şekil-3 deki
A bölmesi yüksek basınçlı tarafı ve B de poröz engeli göstermektedir. Sistem
dengeye geldiğinde sıcaklığı ölçülür. Tüm sistem ısıl olarak izole edilmiştir,
dolayısıyla q = 0 dır.
A nın başlangıç basıncı P1 ve hacmi V1,
buna karşı olan C nin basıncı P2 ve hacmi V2 olsun. B
engelinden itilirken "gazda" yapılan iş P1V1, C
bölmesinde genişlerken "gazın" yaptığı iş P2V2,
gazda yapılan net iş ise w = P1V1 – P2V2
dir. Bu yorum, Joule-Thomson genişlemesinin sabit entalpide gerçekleştiğini
gösterir:
Şekil-3: Joule-Thomson deneyinin
şematik görünümü; A: yüksek basınçlı taraf, C: düşük basınçlı taraf, B: poröz
engel
Bu değer, gazın poröz engellerden geçmesiyle oluşan DP basınç düşmesi sırasındaki DT sıcaklık farkından doğrudan ölçülür.
Pozitif bir m değeri gazın genişlemeyle
soğuduğunu, negatif bir m değeri de
ısındığını gösterir.
Gazların çoğu oda sıcaklığında genişlemeyle soğurlar.
Joule-Thomson genişlemesi, gazların sıvılaştırılmasında çok önemli bir
yöntemdir.
Birinci Kanunun İdeal
Gazlara Uygulanması
İdeal bir gaz termodinamik terimlerle tarif edilirse: (1) iç basınç sıfırdır, (¶U/¶V)T =0
ve, (2) hal denklemine uyar, PV = nRT
İdeal bir gazın enerjisi, sadece sıcaklığının fonksiyonudur.
Denklem(15) den
eşitlikleri yazılır. Keza, gazın ısı kapasitesi de sadece
sıcaklığına bağlıdır. Bu yorumlar ideal gazların termodinamiğini oldukça
basitleştirir.
Aşağıda ideal gazlar için çıkarılan bazı eşitlikler
verilmiştir.
Isı Kapasiteleri
Farkı
Denklem (16), ideal bir gaza uygulandığında (¶U/¶V)T = 0
olduğundan aşağıdaki gibi yazılır.
İdeal bir gaz için, dU = CV dT olduğundan,
İzotermal Tersinir
Hacim ve Basınç Değişiklikleri
İdeal bir gazda tersinir bir değişiklik için iç enerjinin
sabit kalması gerekir. dT = 0 ve (¶U/¶V)T = 0 olduğundan,
Hacim değişiklikleri tersinir olduğundan, P daima denge
değeri n RT / V ye eşittir ve Denklem(21) deki - w, bir genişleme işleminde
yapılan maksimum iş veya bir sıkıştırma için gerekli olan minimum iştir.
Denklem, bir gazı 10 atmosferden 100 atmosfere sıkıştırmak için gereken işin, 1
atmosferden 10 atmosfere sıkıştırmak için gereken iş ile aynı olduğunu
gösterir.
Tersinir Adyabatik
Genişleme
Tersinir adyabatik genişlemede,
Başlangıç ve sondaki sıcaklıklar ve hacimler (T1
ile T2 ve V1 ile V2) arasında integral alınır
(CV nin, sıcaklığın fonksiyonu olmadığı kabul edilir).
Bu denklemlerden elde edilen grafikler Şekil-4 de görülmektedir. Belirli bir basınç düşmesi adyabatik durumda daha az hacim azalmasına neden olur, çünkü adyabatik genişleme sırasında sıcaklık ta düşer.
Şekil-4: Aynı basınç ve hacimdeki
ideal bir gazın izotermal ve adyabatik tersinir genleşmesi.
ÖRNEKLER
273.2 K ve 10 atm basınçta 1 m3 gaz vardır.
Basıncı 1 atmosfere düşürmek için üç değişik genişletme uygulandığında son
hacim ne olur? Gaz, neon gibi monoatomik bir yapıdadır. Monoatomik bir gaz için
molar ısı kapasitesi CVm= 3/2R dir (sıcaklıktan bağımsız).
(b) Adyabatik Tersinir Genişleme: Adyabatik tersinir genişlemede son hacim Denklem(27a)dan hesaplanır.
(c) Adyabatik Tersinmez Genişleme: Basıncın aniden 1 atmosfere düşürüldüğünü ve gazın bu sabit
basınca karşı genişlediğini düşünelim. İşlem tersinir bir proses olmadığından
Denklem(27) uygulanamaz. q = 0, DU = w
dur. DU nun değeri sadece başlangıç ve
son hallere bağlıdır.
Görülüyor ki tersinmez adyabatik genişlemede gazın soğuması
ve yapılan iş, tersinir adyabatik genişlemeye göre daha azdır.
Termokimya -
Reaksiyon Isıları
Termokimya kimyasal reaksiyonlar, çözelti oluşumları, erime
vaya buharlaşma gibi agregasyon (toplanma) halindeki değişikliklerle ilgili ısı
etkilerinin incelendiği konuları kapsar. Fizikokimyasal değişmeler
"endotermik" veya "ekzotermik" olarak sınıflandırılır. Hidrojenin
yanması ekzotermik bir reaksiyondur. 291.15 K’de:
Isıyı sistem verdiğinden işareti negatiftir. Tipik bir
endotermik reaksiyon, su buharının parçalanmasıdır. 291.15 K de:
Diğer ısı transferlerinde olduğu gibi, kimyasal reaksiyonun
ısısı da reaksiyonun yapıldığı koşullara bağlıdır. En önemli iki koşul
"sabit hacim" ve "sabit sıcaklık"tır. Çünkü bunlar
reaksiyon ısılarının, termodinamik fonksiyonlardaki değişikliklere eşit olmasını
sağlarlar. Bir sistemin hacmi sabit tutulduğunda sistem üzerinde herhangi bir
iş yapılmaz ve termodinamiğin birinci kanunu için verilen,
Bu durumda sabit hacimde ölçülen reaksiyon ısısı tam olarak,
reaksiyon sisteminin iç enerji değişikliğine (DU)
eşittir. Sabit basınçta ise,
Sabit basınçta ölçülen reaksiyon ısısı tam olarak, reaksiyon
sisteminin entalpi değişikliğine (DH)
eşittir.
D(PV), tüm sistem
için PV deki değişikliği belirtir; veya bir kimyasal reaksiyon için, ürünlerin
PV değeri ile reaktantların PV değeri arasındaki farkı gösterir.
Tüm reaktantlar ve ürünler sıvı veya katı halde ise PV
değerleri reaksiyon sırasında çok az değişir (özellikle 1 atm gibi düşük
basınçlarda). Böyle hallerde D(PV), DH veya DU
ya göre çok küçük olduğundan ihmal edilebilir; qP ~ qv
Yüksek basınçlardaki reaksiyonlarda D(PV)
dikkate alınır.
Gazların meydana geldiği reaksiyonlarda, D(PV) oluşan gazın mol sayısındaki
değişikliğe bağlıdır. İdeal gaz denkleminden ve Denklem(30)dan aşağıdaki eşitlikler
yazılabilir.
ÖRNEK
Reaksiyon ısısını belirlemek için reaksiyonun tam denkleminin
yazılması, reaktantlar ve ürünlerin hallerinin tanımlanması, ölçümün yapıldığı
sabit sıcaklığın belirtilmesi gerekir. Reaksiyonların çoğu sabit basınç altında
gerçekleştirildiğinden, DH reaksiyon
ısısını gösterir. Örneğin,
Termodinamiğin Birinci Kanununa göre, herhangi bir kimyasal
reaksiyon için DH veya DU yola bağlı değildir, meydana gelebilecek
ara reaksiyonlardan etkilenmez. Bu ilke G.H. Hess tarafından deneysel olarak
ispatlanmış (1840) ve "Sabit Isı Toplamı Kanunu" adı verilmiştir. Bir
reaksiyonun hızı, bu kanuna göre, farklı reaksiyonlar üzerinde yapılan
ölçümlerden hesaplanabilir. Örneğin;
Oluşum Entalpileri
Bir madde için uygun olan standart hal, onun 298.15 K
sıcaklık ve 1atm basınçta kararlı olduğu haldir. Örneğin oksijen O2(g),
kükürt S(rombik kristal), civa Hg(k) şeklindedir;
parantez içindeki harfler, g = gaz, k = kat ı, krs = kristal hali gösterir.
Standart halde elementlerin entalpileri sıfırdır. Herhangi bir bileşiğin
oluşumundaki "standart entalpi"si DHf0,
reaksiyona giren ve çıkan maddelerin standart reaksiyon entalpisidir. Örneğin,
298.15 K de standart bir hal için,
Termokimyasal veriler standart oluşum entalpileri DHf0 ile verilir (Tablo-1). Bu
verilerin pek çoğu, yanma ısıları
ölçümlerinden elde edilmektedir. Yanma ürünlerinin hepsinin oluşum ısıları
bilindiği takdirde, bir bileşiğin oluşum ısısı yanma ısısından hesaplanabilir.
Örneğin karbon ve hidrojenin reaksiyonundan oluşan etanın oluşum ısısı DH2980 = - 84.3 kJ dür
(Tabo-4).
Agregasyon hali değiştiğinde, değişikliğe ait iç ısının
ilave edilmesi gerekir. Monoklinik kükürtün yanmasıyla SO2
oluşumunda aşağıdaki yol izlenir.
298.15 K’deki Standart Oluşum Entalpileri
Çözelti Isıları
Kimyasal reaksiyonların çoğunda reaktantlardan biri veya
daha fazlası çözeltide bulunur. Çözelti ısılarının saptanması termokimyanın
önemli bir koludur. "İntegral çözelti ısısı" ve "diferensiyal
çözelti ısısı" arasındaki farkın belirlenmesi önemlidir.
Seyreltik bir sülfürik asit çözeltisi hazırlandığında
gözlenen durumu her kimyacı bilir. Asit, suya yavaş yavaş ve sabit bir hızla
karıştırılarak ilave edildiğinde, çözelti kararlı bir şekilde ısınır ve sonlara
doğru ısınma hızı azalır; bu şekilde oldukça konsantre bir çözelti elde
edilebilir. 1mol sülfürik asitin n1 mol çözeltiye ilave edilmesindeki
değişiklik aşağıdaki denklemle gösterilir.
Bu reaksiyonda, her mol H2SO4 için
entalpi değişmesi DHs e,
elde elde edilen çözeltiyi veren H2SO4 ün her molü için
"integral çözelti ısısı" denir. Son bileşim mol fraksiyonları
cinsinden,
Tablo-5 de farklı n1 ler için deneysel DHs değerleri verilmiştir. n1
arttıkça elde edilen çözelti daha seyreltik olur ve -DHs (her mol H2SO4 için)
artarak sınır değeri olan DHs
= -96.19 kJ/mol değerine ulaşır; buna "sonsuz seyrelmedeki integral
çözelti ısısı" denir. Tablo-5 deki DHs
değerleri n1/n2 ye karşı grafiğe alındığında, Şekil-5
deki eğri elde edilir; n1/n2, su miktarının sülfürik asit
miktarına oranıdır. İki değişik konsantrasyondaki integral çözelti ısıları
arasındaki fark seyrelme ısısını verir. Örneğin, Tablo-5 den,
Tablo-5 ve Şekil-5 deki DHs
değerlerine integral çözelti ısıları denir, çünkü bu değerler, son n1
konsantrasyonlarının elde edilmesi amacıyla suya ilave edilen H2SO4
lerin tüm DH ları toplamıdır.
Tablo-5: İntegral Çözelti Isıları
Şekil-5: H2SO4
in H2O daki integral çözelti ısısı; herhangi bir bileşimde eğrinin
eğimi, Denklem (35) ten DH1’i
verir. n1/n2 = 1 de DH1
= -17.00 kJ/mol, DH2 =
-11.07 kJ/mol bulunur (Tablo-5).
n1 mol H2O ve n2 mol H2SO4
ün bulunduğu sabit bileşimdeki bir çözeltiye H2SO4 ilave
edildiğinde her mol H2SO4 için meydana gelen entalpi
değişikliğini düşünelim. Böyle bir işlemdeki entalpi değişikliği başlangıçtaki sabit
bileşime bağlıdır, bu nedenle n1 ve n2 nin fonksiyonu
olarak yazılır; DH2(n1,
n2) şeklinde. Bu miktar, H2SO4 in belirlenen
bileşimdeki "diferensiyal çözelti ısısı"dır. H2SO4
i, bir H2SO4 ve H2O çözeltisinde çözeltinin
bileşimini değiştirmeden çözmek olanaksızdır; bu nedenle diferensiyal ısı,
sabit n1 de Dn2 ¾® 0
a giderken DH/Dn2 nin limiti şeklinde tarif edilir.
İntegral ve diferensiyal çözelti ısıları arasındaki ilişki aşağıdaki yorumla bulunur. İntegral DH, iki bileşenin mol sayıları n1 ve n2 ye bağlıdır.
Sabit T ve P deki bir değişiklik
için,
Reaksiyon
Entalpisinin Sıcaklığa Bağlılığı
Bir reaksiyonun DH
değeri bazan bir sıcaklıkta ölçülür, fakat diğer bir sıcaklıktaki değerin
bilinmesi gerekebilir. Böyle bir durum aşağıdaki şema ile gösterilir.
Bu diagramda CP ısı kapasitelerinin sıcaklık
aralığı boyunca sabit olduğu kabul edilmiştir. CPre
terimi, reaksiyonun stökiyömetrik denklemindeki tüm reaktantların ısı
kapasiteleri toplamıdır. CPür de aynı şekilde tüm
ürünlerin ısı kapasiteleri toplamını gösterir. Termodinamiğin birinci kanununa
göre,
Denklem, G. R. Kirchoff tarafından çıkarılmıştır; reaksiyon
entalpisinin sıcaklıkla değişme hızı, ürünler ve reaktantların ısı kapasiteleri
farkına eşittir.
Gerçekte ısı kapasiteleri de sıcaklıkla değişirler. Bu
nedenle, çalışılan sıcaklık aralığı için ısı kapasiteleri ortalama değerinin
kullanılması gerekİr.
Örneğin, Denklem(37)yi kullanmak için aşağıdaki reaksiyonu
inceleyelim.
Küçük bir sıcaklık aralığında sabit CP değerleri
(her mol için): CP(H2O) = 33.56, CP(H2) = 28.83, CP(O2)
= 29.12 J / K mol dür.
Bağ Entalpileri
Bir molekülün oluşum ısısı, molekülü meydana getiren bağların
özelliklerinin toplanmasıyla bulunabilir. Bir reaksiyonda A – B bağı, A ve B
atomları arasından kopsun. Bu durum,
eşitliği ile gösterilir. Reaksiyondaki A - B "bağ
enerjisi" , araştırmacılar tarafından değişik şekillerde tarif edilir: (1)
mutlak sıfırdaki enerji değişikliği, DU00,
(2) mutlak sıfırdaki entalpi değişikliği, DH00;
(3) 298.15 K deki entalpi değişikliği, DH0298.
İlk iki tanım moleküler yapı çalışmalarında önemlidir, üçüncü tanım
termokimyasal veriler ve reaksiyon ısılarının hesaplanmasında kullanılır. Buna
göre A – B bağının bağ enerjisi DH0
(A – B) , reaksiyonun DH0298
değeridir; bu değere "bağ entalpisi" adı verilir.
Denklem(39)daki A ve B, atomlar olabildiği gibi moleküller
de olabilir. Örneğin etandaki C – C bağının DH0
değeri, reaksiyonun DH0298
değeridir.
Verilen bir bağ tipi için DH0
değeri bağın bulunduğu moleküle ve molekül içindeki konumuna bağlıdır. CH4
molekülünden her seferinde bir hidrojen atomunun ayrıldığını kabul edelim.
Bu reaksiyonların herbiri için saptanan DH değeri, dört farklı durumdaki C – H
bağının DH0 ını verir;
yaklaşık değerler sırasıyla 442, 364, 385, 335 kJ / mol dür.
Pek çok uygulamada daha basit bilgiler yeterlidir. Metandaki
dört C - H bağı birbiri ile eşdeğerdir ve karbon atomunun
dört hidrojenle etkileşerek metanı oluşturduğunu kabul edersek, toplam
reaksiyon entalpisinin dörtte biri, metandaki bir C – H bağının ortalama DH0 değeri olur.
Böyle bir ortalama değeri hesaplayabilmek için moleküllerin
atomlardan oluşum entalpileri bilinmelidir. Tüm elementlerin atomizasyon entalpileri
(DH) bilinirse, standart oluşum
entalpilerinden bağ entalpileri hesaplanabilir.
Pek çok durumda, elementlerin monoatomik gazlara
dönüşmelerindeki DH değerini bulmak zor
değildir. Metaller için DH, monoatomik
hale süblimasyon ısısına eşittir. Örneğin,
Diğer bir durum, atomizasyon ısılarının diatomik gazların
disosiyasyon enerjilerinden hesaplanmasıdır. Bazı hallerde atomizasyon DH sini hesaplamak zordur; örneğin, grafitin
süblimasyonunda,
Elementlerin standart atomizasyon entalpileri, tek bağların
ortalama entalpileri, tekli ve çoklu bağ entalpilerini gösteren tablolar
hazırlanmıştır; bunlardan yararlanılarak çeşitli reaksiyonlardaki istenilen
entalpi değerleri hesaplanabilir. Örneğin, etanol (C2H2
OH) için, tablolarda verilen bağ entalpileri standart oluşum entalpileri kabul
edilerek DH0298
bulunur.


GERİ (proje çalışmaları)