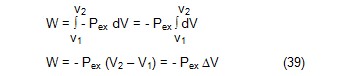Günlük yaşamdaki pek çok olay, temelde bilinmediği halde birtakım kurallar içinde gerçekleşir. Örneğin bir valizi kaldırmak için yer çekimine karşı bir dış kuvvetin uygulanması; masa üzerindeki bir kitabın enerjisinin, yere düşerken biçim değiştirmesi; her an çeşitli şekillerde karşılaşılan denge ve ısı olayları; ısınma, soğuma ve hava basıncı gibi doğa olayları; v.s., daima "Doğa Kanunları" denilen bazı kanunlar ve kurallar içinde gerçekleşir. Fen bilimciler bu kanunların çoğunu çözmüşler ve uzun deneyler ve çalışmalar sonunda matematiksel ifadelere dönüştürebilmişlerdir.
Kuvvet
Maddeye hareket veren kuvveti,
Isaac Newton (1642-1727) aşağıdaki matematiksel ifadeyle tanımlamıştır.
Burada F bir madde parçacığına
uygulanan "kuvvet"i, a parçacığın ivmesini gösterir; ivme, uygulanan
kuvvetle aynı yönde vektöryel bir ifadedir. Eşitlikteki m orantı faktörüdür;
buna kütle denir. İvme, hızın zamana göre birinci türevi, veya hız = yol /
zaman olduğundan, yolun zamana göre ikinci türevidir.
Buradaki kütle x hız'a "momentum" denir.
Uluslararası Birim Sistemine (SI) göre kütle kilogram(kg), zaman saniye(sn),
yol metre(m) ile verilir; bu durumda kuvvet birimi Newtondur (N). Newton çekim
kanununa göre iki kütle arasında, bunların çarpımları ile doğru, aralarındaki
uzaklığın karesi ile ters orantılı bir çekim kuvveti bulunur. G orantı sabitini
gösterirse, çekim kuvveti F aşağıdaki eşitlikle verilir
Bir maddenin W ağırlığı, ona etki eden yer çekimi
kuvvetidir; buradaki ivme g ile verilir ve vakumdaki serbest düşme ivmesidir.
g, yeryüzünün çeşitli yerlerinde çok az farklılıklar gösterir.
Pratikte, bir maddenin kütlesi, ağırlığının bilinen standartlarla
bir terazide kıyaslanmasıyla ölçülür (m1 /m2 = W1
/ W2).
Mekanik İş
Bir F kuvvetinin uygulandığı nokta hareket ederse bu kuvvet
"iş yapmıştır" denir. Uygulama noktası kuvvet yönünde dr kadar
değiştiğinde, F kuvveti tarafından yapılan iş,
Uygulama noktasının hareket yönü, kuvvetle ayni yönde
olmayıp bir q açısı gösterirse
(Şekil-1) yapılan iş,
bağıntısı ile verilir. Kartezyan koordinatlardaki (X, Y, Z)
kuvvet bileşenleri Fx, Fy, Fz ise, dw
aşağıdaki eşitlikle gösterilir.
Bir kuvvetin yönü ve büyüklüğünün sabit olduğu koşulda
Denklem(3)ün integrali yapılan işi (w) verir.
Şekil-1: İşin tanımlanması
ÖRNEK
Kütlesi m olan bir maddeye yerçekimi kuvvetinin etki
ettiğini biliyoruz. Yeryüzünün çapı ile kıyaslandığında çok küçük kalan tüm
mesafeler için F = mg dir. Böyle bir maddenin kaldırılması için yerçekimine
karşı mg çarpımına eşit bir dış kuvvete gereksinim vardır. Kütlesi 1 kg olan
bir maddeyi 1 m kaldırmak için yapılması gereken iş nedir?
w = mgr1
w = 1 kg x 9.80 m/sn2
x 1 m = 9.80 kgm/sn2
w = 9.80 newton metre (Nm) =
9.80 joule
Mekanik Enerji
Enerji sözcüğünü ilk kullanan bilim adamı d'Alambert'tir:
"durgun haldeki bir maddenin enerjisi yoktur, oysa hareket halindeki madde
belirli bir enerji içerir" (1785). Daha sonra Thomas Young enerjiyi
"gerçek" ve "potansiyel" sözcükleriyle tanımladı.
"Kinetik enerji" teriminin kullanılmasına ise çok daha sonra William
Thomson ile başlanmıştır.
Bu gelişmeler Denklem(3)den başlayarak matematiksel olarak
açıklanabilir. r0 konumundaki bir tanecik F(r) kuvveti uygulanarak r1
konumuna getirilsin; bu durumda yapılan iş,
formülü elde edilir. Taneciğe yaptırılan iş, onun son ve ilk
halleri arasındaki kinetik enerjiler arasındaki farka eşittir.
Denklem(8) deki kuvvet sadece r ye bağlı olduğundan,
integral r nin diğer bir fonksiyonunu da tanımlar; bu, -dU(r) dir.
Burada elde edilen U(r) , "potansiyel
enerji"dir. Potansiyel ve kinetik enerjiler toplamı (U + Ek),
maddenin toplam mekanik enerjisidir ve bu toplam, sürtünmesiz hareket boyunca
sabit kalır. Denklem(10), "enerjinin korunması" ilkesini gösterir.
Örneğin, vakumda düşürülen bir maddenin kinetik enerjisinin artması, eşit miktarda
potansiyel enerji kaybetmesiyle dengelenir.
Denge
Kimyasal deneylerde sadece belirli bazı taneciklerden değil,
koşulları yönlendiren daha karmaşık "sistemler"den söz edilmelidir.
Sistemler katı, sıvı ve gaz madde içerebilirler. Bir "sistem",
hareketsiz bir alemden belirli sınırlarla ayrılmış bir parça olarak
düşünülebilir. Ayrılan bu parçanın dışında kalan kısım onun
"çevre"sidir. Sistemin sınırları, çevresindeki herhangi bir
değişikliğin sisteme yansımasına izin vermezse, sistem "izole"
edilmiş olur.
Bir sistemin özellikleri zaman içinde değişme eğilimi
göstermiyorsa, sistem "denge hali"ne ulaşmıştır. Dengedeki bir sistem
tekrarlanabilir niteliktedir ve "hal fonksiyonları" denilen bir seri
özellikle tarif edilir; bunlar sistemin dengeye ulaşmadan önce geçirdiği
durumlara bağlı değildir.
Denge kavramı basit bir mekanik modelle açıklanabilir.
Şekil-2a'da bir kutunun masa üzerindeki üç değişik denge konumu görülmektedir.
A ve C konumlarında kutunun ağırlık merkezleri diğer konumlardan daha
aşağıdadır; bu nedenle küçük bir sarsıntı kutunun bu iki denge konumuna
geçmesine sebep olur. A ve C konumlarında kutuların potansiyel enerjileri en
düşük düzeydedir ve bu hallere "kararlı denge" halleri denir. Şekilde
görüldüğü gibi C hali, A dan daha kararlıdır ve az bir kuvvetle kutu C konumuna
geçmeyi yeğler. Kutunun A konumundaki haline "yarı karalı denge" hali
denir. B konumu da bir denge halini gösterir, fakat bu "kararsız
denge" halidir; bir sandalyenin iki ayağı üzerinde durdurulması bu hale örnek
gösterilebilir. Kutunun B konumundaki ağırlık merkezi, diğer tüm konumlardaki
halinden daha yüksektedir ve en küçük bir sarsıntı onun A veya C haline gelmesine
neden olur.
Kararsız dengede potansiyel enerji maksimumdur; böyle bir
dengeye ancak dengeyi bozabilecek hiçbir kuvvet bulunmadığı zaman ulaşılabilir.
Bu ilişkiler, sistemin potansiyel enerjisinin, Şekil-2a'daki
ağırlık merkezlerinin fonksiyonu olarak grafiğe alınmasıyla daha kolay
gözlenebilir (Şekil-2b). Kararlı denge hali eğride en düşük noktada bulunurken,
kararsız denge hali en yüksek noktadadır. Herhangi bir sitemde kararlı ve
kararsız denge konumları peşpeşe bulunur. Bir denge konumu için, potansiyel
enerjinin yer değiştirmeye göre birinci türevi, yani eğrinin eğimi (dU / dr)
sıfıra eşittir ve denge koşulu,
Maddenin Isıl
Özellikleri
Bir maddenin dengedeki halinin hassas olarak
tanımlanabilmesi için, ölçülen bazı özelliklerinin sayısal değerlerle verilmesi
gerekir. Ancak özellikler arasındaki ilişkileri tarif eden bazı eşitlikler
bulunduğundan, ölçülen her özelliğin belirtilmesi de gerekmez. Dış kuvvet
alanlarının (çekim, elektromagnetik) ihmal edildiği ve maddenin bir gaz veya
sıvı olduğunun varsayıldığı durumlarda, az sayıdaki özellik verileri maddenin
halini tanımlayabilir (katıların özellikleri yöne göre karmaşık bir durum
gösterir). Saf bir gaz veya sıvının halini tarif etmek için öncelikle onun her
durumdaki kütlesi(m) belirlenmelidir. Bunun için de üç termodinamik değişken
olan basınç(P), hacim(V) ve sıcaklık(q)
üzerinde durulur. Bu özelliklerden ikisi sabit olduğunda, deneysel veriler
üçüncünün de sabit kaldığını göstermiştir; yani, değişkenler arasında bir
bağıntı bulunur. Diğer bir deyişle, P, V, q
değişkenlerinden sadece ikisi bağımsız değişkendir. Maddenin halinin, P ve V
ile tanımlandığının, fakat q nın
kullanılmadığının özellikle bilinmesi gerekir.
İçinde sürtünmesiz bir piston olan bir silindirde bir miktar
sıvı madde bulunsun (Şekil-3). Piston sıvının üzerindedir ve üstüne W = F = mg
kuvvetinde bir ağırlık konmuştur. Sıvıya yapılan basınç,
eşitliğinden bulunur. Denge halindeyken bu basınç tüm sıvı
boyunca tek bir değere ulaşır ve sıvı içindeki herhangi bir birim alanda sadece
aynı P kuvveti hakim olur; başka bir deyişle basınç, her yöndeki düzgün bir
gerginlik halidir.
Sıvı dengede olmadığı zaman pistonda dış basınçtan(Pex)
söz edilir. Fakat denge kuruluncaya kadar basınç sıvı içinde sürekli olarak
değişir ve her noktada tek bir P değerine ulaşınca denge kurulur.
Bir sistemin özellikleri "yaygın" veya
"yoğun" olarak sınıflandırılabilir. Yaygın özellikler birbirine
eklenebilir; tüm sistem için değerleri, sistemdeki herbir kısım için olan
değerlerinin toplamına eşittir. Bunlara "kapasite faktörleri" de
denir. Örneğin, hacim ve kütle bu tip özelliklerdir. Yoğun özellikler veya
"şiddet faktörleri" birbirine eklenemez; basınç ve sıcaklık gibi.
Dengedeki bir sistemin küçük bir kısmının sıcaklığı, tüm sistemin sıcaklığına
eşittir.
Sıcaklık q' yı
fiziksel bir değer olarak kullanmadan önce, kantitatif olarak nasıl
ölçüldüğünün bilinmesi gerekir.
Bir maddenin ısısı, yani sıcaklık veya soğukluk derecesi,
onun sıcaklığıdır. Sıcaklık ölçmede "termometre"ler kullanılır.
Bunlarda, belirli bir sıvının standardize edilmiş bir cam boru içindeki hacim
değişikliği izlenir. Bu konudaki çalışmalar 1631 yılında başlamış ve çeşitli
sıcaklık tarifleri yapılmıştır. 1710 yılında, su ile dengede olan buzun
sıcaklığının 0 derece ve kaynayan suyun sıcaklığının da 100 derece olduğu kabul
edilerek, standart cam borudaki civanın hacim değişikliği 100 eşit parçaya
bölünmüş ve "santigrat skalası" veya "Celcius skalası"
belirlenmiştir.
Şekil-3: Bir sıvı içindeki basıncın tanımlanması; sıvıdaki çekim alanı,
yani sıvının kendi ağırlığı ihmal edilmiştir.
Boyle Kanunu
Civalı barometre Toriçelli tarafından keşfedilmiştir (1643).
Atmosfer basıncındaki kolonun yüksekliği günden güne bir kaç cm civa
seviyesinde değişebilir. Fakat "standart atmosfer", bir metre kare
için 101325 Newton’a eşit bir basınçtır (N/m2). Yüksek basınçlar
çoğu kez kilobar (kbar=108 N/m2) ile, düşük basınçlar
torr (atm/760) ile verilir.
Robert Boyle ve arkadaşları bir gazın basıncını bir hava
yayına benzetmişlerdir. Bir hacim gaz bir pistonla silindir içine
sıkıştırılabilir. Ancak piston üzerindeki kuvvet kaldırıldığında, gaz pistonu
yay gibi davranarak geri iter.
Şekil-4 deki gibi, içinde civa bulunan ve bir ucu kapalı
olan J tüpüne açık uçtan civa ilave edildiğinde kapalı uçtaki gazın basıncı
artar, hacmi azalır.
Bu deney basıncın artmasıyla orantılı olarak hacmin
azaldığını, fakat gazın sıcaklığının sabit kaldığını gösterir. Boyle Kanunu:
"Sabit sıcaklıktaki bir gazın hacmi, basıncıyla ters orantılıdır"
şeklinde tarif edilir ve aşağıdaki gibi yazılır (C orantı sabitidir).
Denklem(11)e Boyle Kanunu denir. Kanun orta derecelerdeki
basınçlarda geçerlidir, ancak yüksek basınçlarda sapmalar olur.
Şekil-4: Boyle J tüpü.
Gay - Lussac Kanunu
Gazların hacimleri sıcaklıkla önemli derecelerde değişiklik
gösterir. Bu konudaki ilk çalışmaları 1802-1806 yılları arasında Joseph
Gay-Lussac yapmıştır. çalışmaları azot, oksijen ve hidrojen gibi "kararlı
gazlar"la tekrarlayarak farklı gazların hacimlerinin (V), sıcaklığa (q) aynı derecede bağımlı olduğunu bulmuştur.
Gay-Lussac'ın elde ettiği sonuçlar matematiksel olarak açıklanabilir. Gazların
V hacminin q sıcaklığıyla doğrusal
olarak değiştiğini kabul edelim. Bir gazın 0 0C deki hacmi V0
ise,
a0
katsayısı "ısıl genleşme" veya "ısıl genleşme
katsayısı"dır. Gay-Lussac a’nın
yaklaşık olarak 1/267 ye eşit olduğunu bulmuştur. Ancak Regnault (1847) a’yı daha hassas tayin ederek 1/273 e eşit
olduğunu saptamıştır. Bu değer kullanıldığında Denklem(11) aşağıdaki şekilde
yazılır.
Bu bağıntıya "Gay-Lussac Kanunu" denir;
"sabit basınçtaki bir gazın sıcaklığı bir derece arttığında hacmi, 0 0C
deki hacminin 1/273 katı kadar artar".
Gerçek gazlar Boyle ve Gay-Lussac kanunlarına uymazlar;
gazın yüksek sıcaklıkta ve düşük basınçta olması sapmayı azaltır. Sapma gaza
göre de değişir; örneğin, helyumda az, karbon dioksitte fazladır. Bu kanunlara
tam olarak uyan gazlara "ideal gazlar" denir. Gazlar düşük
basınçlarda (yoğunlukları da düşüktür) kanunlara daha yakındırlar. Bu nedenle
gerçek gazların ölçüm değerleri sıfır basınca ektrapole edilerek ideal gaz
özellikleri elde edilir.
Şekil-5 te azot, H2 ve He’un a0 değerleri görülmektedir. Sıfır
basınçta her üçü için de aynı a0
değeri elde edilir; bu ise ideal bir gazın değerine eşittir.
eşitliği ile verilir. Burada yeni bir sıcaklık skalası
tarifine gereksinim vardır; T = mutlak sıcaklıktır ve birimi Kelvin, K dir.
Böylece, T = q +T0
olduğundan, Gay-Lussac Kanunu aşağıdaki şekilde yazılabilir.
Şekil-5: Isıl genleşme
katsayılarının sıfır basınca ekstrapolasyonu
Mol Tanımları
"Bir maddenin miktarı" önemli bir fizikokimyasal
değerdir. Madde miktarının SI birimi "mol"dür. Mol, karbon atomunun
tam olarak 0.012 kg karbon-12 olduğu varsayıldığında, çeşitli elementer
birimlerden oluşan bir sistemin miktarını gösterir. Elementer birim bir atom,
bir molekül, bir iyon, bir elektron, bir foton, v.s. veya belirlenmiş bir grup
olabilir.
Örneğin, 1 mol Hg Cl nin kütlesi, 0.23604 kg; 1 mol Hg2
Cl2 nin kütlesi, 0.47208 kg; 1 mol Hg nın kütlesi, 0.20059 kg; 1 mol
Cu0.5 Zn0.5 in kütlesi, 0.06446 kg; 1 mol Fe0.91
S in kütlesi, 0.08288 kg; 1 mol e- un kütlesi, 5.4860 x 10-7
kg; 1 mol (%78.09 mol N2 + %20.95 mol O2 + %0.93 mol Ar +
%0.03 mol CO2) in kütlesi, 0.028964 kg dır.
İdeal Bir Gazın Hal
Denklemi
P, V, T değişkenlerinden herhangi iki tanesi, belirli miktardaki
bir gazın halini tanımlar ve üçüncü değişkeni de sabit tutar. Denklem(11) sabit
T de P nin V ile, Denklem(14) de sabit P de V nin T ile olan değişiklilerini
göstermektedir.
Bu iki eşitlik birleştirilebilir; şöyle ki, gazın ilk
bulunduğu hal P0, V0, T0 ile, ikinci hal de P,
V, T ile gösterilsin. Gaz ilk haldeyken T0 sabit tutularak basınç P
ye yükseltilir; bu durumda hacim Vx gibi bir değere değişir. Sonraki
aşamada P sabit tutulur ve sıcaklık T0 dan T değerine çıkarılır,
hacim ise V değerine gelir.
İdeal bir mol gaz için P0 = 1 atm, T0
= 273.15 K dir. Bu koşullarda V0 = 22414 cm3/mol (V0/n)
dür. Avagadro Kanununa göre bu hacim tüm ideal gazlar için geçerlidir. n mol
ideal gaz için,
R ye "her mol için gaz sabiti" denir. Bu eşitlik
"ideal bir gazın hal denklemi" olarak bilinir. Denklem üç kanunu
birarada içermektedir; Boyle, Gay-Lussac, ve Avagadro kanunları. İdeal gaz
sabiti R çeşitli birimlerle verilebilir, bazıları Tablo-1’de gösterilmiştir.
Denklem(16), bir gazın yoğunluğundan molar kütlesinin(M)
hesaplanmasına olanak verir. Hacmi V olan bir gazın kütlesi m ise, r yoğunluğu ve n miktarından, Denklem(16)
kullanılarak M değeri bulunur.
Hal Denklemi ve PVT
İlişkileri
Bağımsız değişkenler olarak P ve V seçildiğinde, n
miktardaki saf bir maddenin sıcaklığı P ve V nin fonksiyonu olur. Vm
=V/n ise,
T nin sabit bir değeri için, bu eşitlik bir izotermi tarif
eder. Isıl dengede, bir maddenin hali, üç değişken olan basınç, molar hacim ve
sıcaklıktan herhangi ikisinin belirlenmesiyle sabitleştirilir; sonra üçüncü değişken,
Denklem(17) nin çözülmesiyle bulunur. Denklem(17) "hal denklemi"nin
genel ifadesidir ve özel bir bağımsız değişken olmadığında, (P, Vm,
T) = 0; örneğin, (P V – n RT) = 0.
Geometrik olarak düşünüldüğünde, denge halindeki saf bir
sıvı P, V, T ile gösterilen üç boyutlu bir yüzeydir. Şekil-6a’da ideal bir gaz
için böyle bir PVT yüzeyi görülmektedir. Sabit sıcaklıktaki noktaların
birleştirilmesiyle elde edilen izotermal hatlar PV düzleminde bulunur
(Şekil-6b). Sabit hacim hatları PT düzlemindedir ve "izokorlar" veya
"izometrikler" adını alır (Şekil-6c). İdeal olmayan bir gazda bu
hatlar düz değildir. Sabit basınç hatlarına "izobarlar" denir.
İzobarik bir eğrinin eğimi, seçilen sabit bir basınçta
sıcaklıkla hacmin değişme hızını verir. Bu nedenle eğim (¶V / ¶T)p
şeklinde gösterilir. Burada kısmi türev alınmasının nedeni, V nin T ve P nin
fonksiyonu olmasıdır. V nin T ile değişme fonksiyonu a ile gösterilir ve "ısıl genleşme" olarak tanımlanır,
birimi 1/T dir.
Şekil-6: (a) Bir ideal gaz için PVT yüzeyi; kesiksiz çizgiler izomerler, kesikli çizgiler izobarlar, noktalı çizgiler izometriklerdir. (b) PVT yüzeyinin PV düzlemindeki görünümü; izotermleri gösterir. (c) PVT yüzeyinin PT düzlemindeki görünümü; izometrikleri gösterir.
Benzer şekilde izotermal bir eğrinin eğimi, sabit sıcaklıkta
basınçla hacmin değişmesini verir. Bu değişiklik b
terimi ile gösterilir ve bir maddenin "izotermal sıkıştırılabilmesi"ni
tanımlar. Negatif işaret, basınç artmasının hacim azalmasına neden olmasından
dolayıdır; bu durumda (¶V / ¶T)T
negatif olur; b birimi 1/P dir.
Hacim hem T nin hem de P nin fonksiyonu olduğundan,
diferensiyal bir değişiklik(dv) aşağıdaki şekilde gösterilir.
Denklem(20), Şekil-7'deki grafikle gösterilir; burada dikey
eksen V dir ve PVT yüzeyinin bir kısmı verilmiştir. abcd alanı, yüzey alanının
bölünemeyecek kadar küçük bir parçasıdır; VT ve VP düzlemlerine paralel
düzlemlerle yüzeyden kesilerek elde edilmiştir. Gaz a noktasındayken hal
değişkenleri Va, Pa, Ta dır. P ve T
bölünemeyecek kadar küçük miktarlarda değiştirilerek P + dP ve T + dT yapıldığında
sistem c noktasıyla gösterilen hale gelir ve V deki değişiklik dV,
Vb – Va, P nin sabit olduğu ve sadece
sıcaklığın değiştirildiği durumda V deki değişikliktir. Bu nedenle ab nin eğimi
(P = sabit),
Vb – Va nın bölünemeyecek kadar küçük
miktarda değişmesi (¶V / ¶T)p
dT dir. Aynı şekilde Vc – Vb, (¶V / ¶P)T dP dir. V deki toplam değişiklik, Denklem(20)de
görüldüğü gibi bu iki kısmi değişikliğin toplamıdır.
Kısmi diferansiyel katsayılar (a ve b) arasında ilginç
bağıntılar elde edilebilir. Denklem(20)nin çözümüyle dP bağıntısı çıkarılır.
Keza, Denklem(20) ye benzer olarak dP için aşağıdaki genel
eşitlik de geçerlidir.
ÖRNEK
Laboratuvarlarda çok karşılaşılan bir olay, civalı cam
termometrelerin aşırı ısınma halinde kırılmasıdır. Bir termometre 50 0C
de civa ile tamamen doldurulmuşsa, 52 0C ye ısıtıldığında ne kadar
basınç meydana gelir? Bu koşullardaki civa için a
=1.8x1004 1/0C, b
= 3.9x10-6 1/atm dir.
Görülüyor ki 46 atmosfere dayanabilen cam boru, 92 atmosfer
gibi bir basınçla karşılaşmaktadır. Bu durumda termometrenin kırılması sürpriz
olmamalıdır.
Gerçek Gazların PVT
Davranışı
Gazlar, sıvılar ve katıların basınç, hacim, sıcaklık (PVT)
ilişkileri genel olarak Denklem(17) ile tarif edilir. Ancak, sadece gazlar için
önemli hal denklemleri çıkarılabilmiştir.
İdeal gaz denklemi PV = n RT, bir yaklaştırma yapılarak
gerçek gazlara da uygulanabilir. Bir gazın ideallikten sapmasını gösteren uygun
bir yol, ideal gaz denklemine "sıkıştırılabilme faktörü" denilen bir
z faktörü konulmasıdır.
z faktörüne "sıkıştırılabilme faktörü" denir.
İdeal bir gaz için z = 1 dir. Gaz ideallikten ayrıldıkça z değeri 1 den sapar.
İdeallikten sapma sıcaklık ve basınca bağlıdır; yani z, T ve P nin bir
fonksiyonudur. Şekil-8 de bazı sıkıştırılabilme faktörü (T = 0 0C
de) eğrileri görülmektedir; bunlar değişik basınçlarda maddelerin hacimlerinin
ölçülmesiyle yapılan verilere göre çizilmiştir. (NH3 ve C2
H4, yüksek basınçlarda sıvı maddelerdir.)
Şekil-8: Sıkıştırılabilme
faktörleri; z = PV / n RT, 0 0C’de
Uygun Haller Kanunu
Belirli bir sıcaklık ve basınçta, buharı ile dengede olan
bir sıvının denge basıncına, bu sıvının "buhar basıncı" denir. Sıvı
buhardan daha yoğundur.
Böyle bir sistem kapalı ve şeffaf bir tüp içinde ise, sıvı
ve buharı arasında iki fazın varlığını gösteren bir menisküs gözlenir. Ancak,
her maddeye özgü olan ve kritik sıcaklık (Tc) denilen bir sıcaklığın
üstünde sisteme ne kadar basınç uygulanırsa uygulansın tek faz bulunur. Tc
değerinin üstündeki sıcaklılarda madde "akışkan (mayi) halde"dir.
Akışkanı Tc de sıvılaştıran basınç "kritik basınç (Pc)"
tır. Maddenin Tc ve Pc de kapladığı molar hacim de
"kritik hacim", Vc dir. Bazı maddelerin kritik değerleri
Tablo-2 de görülmektedir.
P, V, T değerleri Pc, Vc, Tc
kritik değerlerine bölündüğünde "indirgenmiş" basınç, hacim, sıcaklık
değerleri elde edilir.
van der Waals, özellikle orta basınçlarda, hal değişkenleri
PR, VR, TR ile tanımlandığında [VR
=f (PR; TR) gibi] tüm gazların ayni hal denklemine
uygunluk gösterdiğini ileri sürmüş ve bu kurala "Uygun Haller Kanunu"
adını vermiştir. Bu kanun doğru ise, tüm gazların kritik oranı Pc Vc
/ RTc nin ayni olması gerekir Gerçekten de Tablo-2 deki değerlerden
hesaplandığında bu oranın sadece 3-5 gibi bir aralıkta değiştiği görülür.
Sıkıştırılabilme faktörü z ile indirgenmiş PR ve
TR değerleri arasında, yüksek basınçlarda bile, ilginç bir bağıntı
bulunur; z, PR ve TR nin bir fonksiyonudur.
z nin P ve T ile değişimi (z = PV/RT), PV ye karşı grafiğe
alındığında Şekil-9 daki eğriler elde edilir. Kimya mühendisleri ve araştırmacılar
gazların yüksek basınçlardaki özelliklerini incelerken bu grafiklerden
yararlanırlar.
Şekil-9: İndirgenmiş hal
değişkenlerinin fonksiyonu olarak sıkıştırılabilme faktörleri
Gazların Hal
Denklemleri
Hal denklemi indirgenmiş değişkenlerle yazılırsa, F (PR,
VR) = TR gibi, en az iki bağımsız sabit içerecektir;
örneğin Pc ve Vc gibi. İdeal gaz denkleminden daha doğru
PVT verilerinin elde edildiği çok sayıda hal denklemi vardır. Bunlardan en çok
bilinen ikisi aşağıda verilmiştir.
Örneğin, van der Waals denklemi:
van der Waals denklemiyle, ideallikten orta derecedeki
sapmalarda doğruya çok yakın PVT verileri elde edilir.
Kritik Bölge
Bir gazın kritik bölge yakınındaki davranışı, ilk defa
Thomas Andrews tarafından incelenmiştir (1869). Andrews karbon dioksit ile bir
dizi deneyler yapmıştır. 1937 de A. Michels ve arkadaşları karbon dioksitin
kritik sıcaklık 31.01 0C dolayındaki PV izotermlerini içeren bir yayın
çıkarmışlardır (Şekil-10).
Şekil-10 daki 30.4 0C izoterminde (Tc
den düşüktür) PV eğrisi Önce AB yolunu izler, bu yaklaşık olarak bir Boyle
kanunu izotermidir. B noktasına ulaşıldığında bir menisküs meydana gelir ve
sıvı oluşumu başlar. C noktasına kadar sabit basınçta sıkışma devam eder; bu
noktada tüm gaz sıvı hale dönüşmüştür. CD eğrisi sıvı karbon dioksitin
izotermidir; eğrinin dikliği sıvının sıkıştırılabilme özelliğinin düşük
olduğunu gösterir. Daha yüksek sıcaklıklardaki izotermlere doğru gidildiğinde,
31.01 0C izotermine ulaşılıncaya kadar B ve C noktalarının birbirine
yaklaştığı görülür. 31.01 0C izotermi, karbon dioksitin kritik
sıcaklıktaki izotermidir. Bu sıcaklığın üstündeki izotermler, ne kadar yüksek
basınç uygulanırsa uygulansın ikinci bir faz oluşumu göstermezler.
Kritik sıcaklığın üstünde tam bir "devamlı haller"
bulunduğundan, sıvı ve gaz arasında herhangi bir ayırım yapılamaz. Bu durum
EFGH yolunu izleyerek gösterilebilir. Sıcaklığı Tc den daha düşük
olan E noktasındaki gaz sabit hacimde ısıtıldığında, Tc den daha
yüksek sıcaklıktaki F noktasına gelir. Sonra FG izotermi boyunca sıkıştırılır
ve sabit hacimde GH yoluyla soğutularak H noktasına getirilir; bu noktanın
sıcaklığı Tc den düşüktür. Karbon dioksit H de sıvı haldedir, fakat
izlenen bu yol boyunca hiç bir zaman iki faz (sıvı ve gaz) bir arada bulunamaz.
Gaz halinden sıvı haline geçiş düzgün ve süreklidir.
Van Der Waals
Denklemi ve Gazların Sıvılaştırılması
van der Waals denklemİ, ideal halden sadece orta derecelerde
sapmalar gösteren gazlar İçİn oldukça doğru PVT verileri verir. Şekil-10 da
kesikli çizgilerle gösterilen eğriler ideal halden sapmaları, yani van der
Waals izotermlerini göstermektedir. van der Waals denklemi homojen gazlar ve
hatta homojen sıvılar için bile daha iyi sonuçlar verir. van der Waals izotermi
sıvılaşma süreci boyunca sabit bir basınç göstermez, bir maksimum ve bir
minimum verir. Sıcaklığın kritik değere doğru yükselmesi bu maksimum ve
minimumun birbirine yaklaşmasına yol açar. Kritik değerde bu iki nokta PV
eğrisinin dönüm noktası halini alır.
Şekil-10: Karbon dioksitin kritik
bölge yakınındaki izotermleri
Bir maksimum için analitik koşul:
van der Waals denklemine göre, 1 mol (n = 1) gaz için,
kritik noktada (T = Tc, V = Vc, P = Pc)
aşağıdaki üç denklem aynı anda geçerlidir.
İndirgenmiş hal değişkenleri PR, VR, TR
kullanılarak da van der Waals denklemi yazılabilir. Şöyle ki,
İdeal Gaz Karışımları
Bir karışım n1, n2, ...nj...nc
miktarlarda maddeler içeriyorsa, toplam miktar,
denklemi ile verilir. Karışımın bileşimi, her bir maddenin
mol kesrinin belirtilmesiyle tarif edilir; örneğin j maddesinin mol kesri,
İncelenen sistem bir gaz karışımı ise, karışımda bulunan her
bir bileşenin "kısmi basınç"ından söz edilir; P1, P2,
...Pj... gibi. Bileşenin konsantrasyonu bilinirse, PVT verilerinden
veya hal denkleminden kısmi basıncı bulunabilir.
Her bir bileşenin ideal bir gaz gibi davrandığı,
durumunda bile birbirine benzemeyen gazlar arasındaki
etkileşim ΣPj
nin P den biraz farklı olmasına yol açar. Bu nedenle "ideal gaz
karışımı",
Her gazın ideal bir gaz gibi davrandığı karışım, "ideal
gazların ideal bir karışımı"dır.
eşitliği bulunur. Buna göre, ideal bir gaz karışımındaki
herbir gazın kısmi basıncı, kendi mol kesri ile karışımın toplam basıncının
çarpımına eşittir. Sabit bileşimdeki bir gaz karışımının PVT davranışı,
karışımın saf ve tek bir madde olduğu varsayılarak tayin edilir. Elde edilen
veriler bir hal denklemine uygulanarak parametreler hesaplanır. Bulunan
değerler karışımın bileşimine bağlı parametre değerleridir.
Isı ve Isı Kapasitesi
Kavramları
"Sıcaklık" olayını açıklayan deneysel gözlemler
ayni zamanda "ısı" kavramını da açıklar. Fakat çoğu zaman bu iki
kavram birbirine karıştırılmaktadır.
"Sıcaklık" yoğun (intensive), "ısı
miktarı" yaygın (extensive) özelliklerdir. Yaygın özellikler toplanabilir,
yoğun özellikler ise toplanamazlar (sıcaklık, basınç).
Joseph Black "kalorimetre" ile yaptığı ve 1803 te
yayınladığı çalışmasında, ısının bir madde gibi davrandığını, bir ortamdan bir
diğerine geçebildiğini, fakat toplamının daima sabit kaldığını kabul etmiştir.
Bu görüş diğer araştırmacılar tarafından da benimsenmiştir. Tipik bir örnekle
konu daha iyi anlaşılabilir. Kütlesi m2, sıcaklığı T2
olan küçük bir kütle, içinde kütlesi m1, sıcaklığı T1
olan su bulunan bir kap içine konulsun. Bu durumda bulunması gereken koşullar:
(1) sistem çevresinden izole edilmiştir, (2) kap içinde herhangi bir değişiklik
olmayacağı varsayılmıştır, (3) buharlaşma, ergime, çözünme veya kimyasal
reaksiyonların bulunmadığı kabul edilmiştir. Bu koşullarda, sistem T gibi yeni
bir sıcaklığa ulaşır; T, T1 ve T2 arasında bir değerdir
ve sıcaklıklar arasında aşağıdaki denklemle verilen bir eşitlik bulunur.
Burada c2 metalin "öz (spesifik)
ısı"sı, C2 = c2 m2 deneyde kullanılan
metalin "ısı kapasitesi"dir. Ayni şekilde, suyun öz ısısı c1,
kullanılan suyun ısı kapasitesi C1 = c1 m1
dir. Öz ısı, birim kütlenin ısı kapasitesidir.
Denklem(36), Denklem(10) dakine benzer bir korunma
denklemidir. Yapılan deney koşullarında ısının korunduğu ve sıcaklıkları
eşitleninceye kadar daha sıcak ortamdan daha soğuk olana doğru aktığı
düşünülebilir. Akan ısı q,
"Isı birimi" gram kaloridir (g kal) ve bir gram
suyun sıcaklığını 1 0C yükseltmek için absorblanması gereken ısı
miktarı olarak tarif edilir.
Öz ısı sıcaklığın bir fonksiyonudur. Bu durumda kalorinin,
sıcaklık ta belirtilerek daha hassas bir tarifi yapılmalıdır. Standart olarak
15 0C deki kalori alınmıştır; 1 kalori, 1 g suyun sıcaklığını 14.5 0C
den 15.5 0C ye çıkarmak için verilmesi gereken ısı miktarıdır. Isı
kapasitesi sıcaklığın bir fonksiyonu olduğundan, diferensiyal bir ısı akışı dq
ve sıcaklık değişimi dt ile hassas olarak tarif edilir.
Isı transfer deneyinde sistemin tamamen izole olduğu ve
çevresiyle herhangi bir mekanik etkileşimde bulunmadığı kabul edilmişti. Bu
sınırlamalar olmadığında, sistem ya çevresinde veya kendinde iş yapar. Her iki
durumda da bir maddeye ilave edilen ısının sadece bir kısmı onun sıcaklığını
yükseltirken, kalan kısım maddenin yaptığı işe harcanır.
Diferensiyal iş Denklem(3)de dw = F dr şeklinde tarif
edilmişti. İş, kuvvet ile kuvvetin uygulandığı noktanın kuvvet yönündeki yer
değiştirmesinin çarpımıdır. Şekil-3 deki sistem sürtünmesiz hareket eden bir
pistonun bulunduğu ve bir sıvı içeren termodinamik bir sistemdir. Alanı A olan
piston üzerindeki dış basınç Pex = F/A dır. Piston F kuvveti yönünde
dr kadar hareket ettiğinde yapılan iş,
Buradaki iş, kuvvet tarafından yapılan iştir. Mekanik
olaylarda iş daima kuvvetle ilişkilidir. Kuvvetin bir kütle noktasına, bİr
kütle noktaları toplamına, sürekli bir ortama veya sisteme uygulanması önem
taşımaz, uygulandığı noktanın yer değiştirmesi işin hesaplanması için
yeterlidir. Termodinamikte sistem ve çevresi önemlidir. "Sistemde" ve
"sistemden"" yapılan işler vardır. Sistemde yapılan iş (+), sistemden
çevreye yapılan iş ise (-) işaretle gösterilir; buna göre sistemde yapılan iş,
Buradaki negatif işaret, sıkıştırmada dV nin negatif
olmasındandır. Pex, sistemde iş yapılabilmesi için uygulanan dış
basınçtır. Sistemin bu dış basınçla dengede olması gerekmez. Sistem V1
den V2 ye kadar sıkıştırıldığında basınç sabit tutulursa, sıvı
üzerinde yapılan iş Denklem(38)den hesaplanır.
Dış basıncın ardarda gelen her noktada (genişleme veya
sıkışma) bilindiği bir hacim değişikliğinde, Pex değerleri V
değerlerine karşı grafiğe alınabilir. Böyle bir grafiğe "indikatör
diyagramı" denir. Şekil-11a da görülen örnekte sistem tarafından yapılan
iş eğrinin altındaki alana eşittir.
A noktasından B noktasına gidilirken yapılan iş geçiş yoluna
bağlıdır. Örneğin, A dan B ye Şekil-11b deki gibi iki değişik yoldan gidilsin.
ADB yolunda, ACB yolunun izlenmesinde olduğundan daha fazla iş yapılır; çünkü
ADB nin altındaki alan ACB nin altındakinden daha büyüktür. Eğer ADB yoluyla B
ye ulaşılıp, buradan da BCA yoluyla tekrar A ya dönülürse tamamlanmış bir
"halkalı işlem" yapılmış olur; sistemin yaptığı net iş, eğrilerin
altındaki alanların farkına eşittir.
Termodinamik yorumlarda, sistemden veya çevresinden
sözcüklerini kullanırken neyin tarif edilmek istendiğinin çok iyi bilinmesi
gerekir. Şekil-3 deki örnekte pistonun ağırlığının olmadığı ve sürtünmesiz
çalıştığı varsayılmıştı. Bu durumda, sistem gazdır, piston ve silindir ise gazı
çevreleyen ideal sınırlardır. Gerçek bir silindir ve sürtünmeli bir pistonun
olduğu halde ise piston ve silindirin sistemin bir parçası mı yoksa çevrenin
bir parçası mı olduğunun dikkatli bir şekilde belirtilmesi gerekir. Pistonda
çok fazla iş yapılırken bunun sadece bir kısmı gaza iletilir, kalan kısım
piston tarafından sürtünme ısısı olarak harcanır.
Pex - V eğrisi boyunca ardarda gelen her nokta
sistemin bir denge hali ise, çok özel bir durum olan Pex = P
eşitliği gerçekleşir; P sıvının kendi basıncıdır.
Şekil-11: PV işi için indikatör
diyagramı; (a) A’dan B’ye giden genel bir işlem, (b) bir ADBCA halkalı sistem.
(c) Dengede bir mayi içeren bir sistemde yapılan işin indikatör diyagramı; Pex
= P
İndikatatör eğri, bu durumda sistemin denge eğrisi olur.
Böyle bir durum Şekil-11 (c)’ de görülmektedir. Sadece denge hali devam
ettiğinde, işin hesabı maddenin kendi hal fonksiyonlarından (P ve V)
yapılabilir.
Genel İş Kavramı
Mekanik sistemlerde iş daima iki terimin çarpımı olarak
verilir; yoğun bir faktör olan kuvvet ve yaygın bir faktör olan yer değiştirme.
Mekanik olmayan iş tanımlarında da böyle bir formülasyon uygulanır.
Fizikokimyada elektrik hücrelerinde oluşan değişiklikler
geniş bir inceleme konusudur. Elektriksel iş de kuvvet hücrenin elektromotor
kuvvetidir (emf) ve E ile gösterilir. Yer değiştirme de hücre deşarj olurken
(dQ < 0) dış devre boyunca transfer olan şarjdır (dQ). Magnetik bir durumda
ise yoğun faktör magnetik alan kuvveti, H dir. Bu alan bir maddeye etki ederek
alan yönünde bir dM magnetikliği yarattığında madde üzerinde yapılan iş HdM ye
eşit olur. Çeşitli iş tanımları Tablo-3 de gösterilmiştir.
Tersinir İşlemler
(Prosesler)
Şekil-11 (c)'de görülen PV diyagramında izlenen yol özel bir
durumu belirtir ve termodinamik anlamda çok önemlidir; buna "tersinir
yol" denir. Tersinir bir yol, denge halindeki tüm ara halleri bağlayan tek
yoldur. Böyle bir denge yolu boyunca ilerleyen işlem "tersinir
işlem"dir. Örneğin, bir gazın tersinir genleşmesinde piston üzerindeki
basınç sonsuz derecede yavaş kalkmalıdır. Bu durumda gaz hacminin her yerindeki
basınç daima ayni ve piston üzerindeki zıt basınca eşit olur. Sadece böyle bir
koşuldaki gazın hali P ve V hal değişkenleriyle tanımlanabilir. (Tersinmez hal,
indikatör diyagramında Pex in V ye karşı grafiğe alınmasıyla
gösterilir. Sadece tersinir durumda Pex = P dir, bu hal maddenin
kendi özelliğinden kaynaklanır.) Geometrik terimlerle ifade edildiğinde gazın
hali PV düzlemindeki bir nokta ile gösterilir. Böyle noktaları birleştiren hat,
bir denge noktaları birleştirme hattıdır. Piston aniden geri çekildiğinde gaz
hızla boş yerleri doldurmaya çabalar, gaz hacmi boyunca basınç farkları oluşur,
hatta türbülens bir hal meydana gelir. Bu koşuldaki bir gazın hali P ve V
değişkenleri ile tanımlanamaz.
Çeşitli noktalarda çeşitli basınçlar bulunacağından çok
sayıda değişken bulunur. Bu tür bir hızlı genişleme tipik bir "tersinmez
işlem"dir; ara haller dengede değildir.
Tersinir işlemler sonsuz yavaş ilerleyebilen işlemler
olduğundan gerçekleşemezler. Bu nedenle doğal işlemlerin tümü tersinmezdir.
Tersinir yol, tersinmez bir işlemin denge koşullarına çok yakın koşullarda
yapılması halinde ulaşılan sınır yoldur. Gerçek bir tersinirlik sağlanamamasına
rağmen tersinir yol tam olarak tanımlanabilir ve bu yol boyunca yapılan iş
hesaplanır. Ancak, tersinirlik koşullarında yine de deneylerde yaklaştırmalar
yapılır.
Şekil-11 (c) de A dan B ye giden bir yol gösterilmiş
olmasına rağmen, B ye farklı yollardan da ulaşılır. Çünkü hacim V, basınç P nin
olduğu gibi sıcaklık T’nin de bir fonksiyonudur. İşlem boyunca tek bir sıcaklık
seçilir ve sabit tutulursa sadece bir tersinir yol olasıdır. Böyle bir
"izotermal koşul"da A dan B ye tersinir bir yol ile giden sistem
üzerinde yapılan iş, seçilen sıcaklık için "minimum iş" olarak tarif
edilir. Bu yorum doğrudur, çünkü tersinir durumda genişleme en yüksek zıt kuvvete
karşıdır; zıt kuvvet ise itme kuvveti ile dengededir.
GERİ (proje çalışmaları)