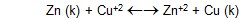18.2. HÜCRE
POTANSİYELLERİ
Şekil-1'de görülen galvanik hücreye Daniell hücresi veya
pili denir. Daniell hücresinin potansiyeli iki elektrolit çözeltsindeki
katyonların konsantrasyonuna bağlıdır; bunlar birbirine eşitse 1.1 V luk bir
voltaj oluşur. Akım alınırken bakır iyonu konsantrasyonu azalırken çinko iyonu
konsantrasyonu eşdeğer miktarda artar. Hücre potansiyeli buna uygun derecelerde
azalır ve sıfıra iner; bu noktada hücre reaksiyonu denge durumuna ulaşır.
Hücre potansiyeli ile bir hücre reaksiyonundaki maddelerin
konsantrasyonları arasındaki ilişki termodinamik kavramlardan yararlanılarak
çıkarılır.
Tüm termodinamik hesaplamalarda olduğu gibi, hesaplanan ve
deneysel verilerden elde edilen potansiyellerin saptanmasında molar
konsantrasyonlar yerine aktivite değerleri kullanılır. Bu nedenle bu iki
konsantrasyon parametresini ve aralarındaki ilişkiyi kısaca hatırlamak yararlı
olacaktır.
Bir maddenin aktivitesi(aM) ve molar
konsantrasyonu ([M]) arasındaki ilişki,
eşitliği ile tarif edilir. Burada fM aktivite
katsayısıdır ve birimsizdir. M nin aktivite katsayısı (ve tabii aktivitesi),
çözeltinin iyonik şiddeti ile değişir, böylece elektrot potansiyeli
hesaplarında [M] yerine aM kullanılması halinde iyonik şiddet hesaplarına
gerek kalmaz.İyonik şiddet (m)aşağıdaki
denklemle verilir.
Burada M1, M2, M3, ---
çözeltideki çeşitli iyonların molar konsantrasyonları ve Z1, Z2,
Z3, --- bunların yükleridir. Bir iyonik şiddetin hesaplanmasında
sadece reaksiyona giren iyonlar dikkate alınmalıdır.
a. Bir iyonun veya grubun aktivite katsayısı onun da
bulunduğu bir denge olayındaki etkisini gösterir. Çok seyreltik çözeltilerde
(iyonik şiddet en düşük düzeydedir), bu etki sabit olur ve aktivite katsayısı
1'e yaklaşır; bu durumda aktivite ve molar konsantrasyon sayısal olarak
eşitlenir. İyonik şiddet arttıkça, iyon etkinliğinin bir kısmını kaybeder ve
aktivite katsayısı azalır.
Bu davranışı (2) numaralı denklemle açıklayabiliriz. Orta
derecelerdeki iyonik şiddetlerde, fM < 1; çözelti sonsuz
seyrelmeye yaklaştığında ise, fM
¾®1 ve aM ¾® [M] şeklini alır. Yüksek iyonik
şiddetlerde, bazı maddelerin aktivite katsayıları artar ve hatta 1'den büyük
değerlere kadar çıkabilir. Bu gibi çözeltilerin davranışlarını açıklamak
zordur; burada düşük ve orta derecedeki iyonik şiddetlerin (m < 0.1) bulunduğu ortamlar
incelenecektir. (Bazı tipik aktivite katsayıları değerlerinin iyonik şiddet ile
değişimleri Şekil-8'de verilmiştir.)
b. Seyreltik çözeltilerde; bir maddenin aktivite katsayısı elektrolitin
özel yapısına bağlı olmayıp sadece iyonik şiddetine bağlıdır.
c. Belirli bir iyonik şiddette, bir iyonun taşıdığı yük
arttıkça aktivite katsayısının 1 den sapması da artar. Bu etki Şekil-8'de
görülmektedir. Yüksüz bir molekülün aktivite katsayısı iyonik şiddete bağlı
olmaksızın, yaklaşık 1'dir.
d. Aynı yüklü iyonların aktivite katsayıları aynı iyonik
şiddetler için yaklaşık aynıdır. Farklılıklar hidratlı iyonların etkin çapları
ile ilişkili olabilir.
e. Bir iyonun aktivite katsayısı ve molar konsantrasyonu
çarpımı, bu iyonun bulunduğu denge olaylarındaki etkinliğini gösterir.
Şekil-8: İyonik
şiddetin aktivite katsayılarına etkisi
Aktivite Katsayılarının Değerlendirilmesi: P.Debye ve E.Hückel (1923), iyonların
aktivite katsayılarını hesaplamak için aşağıdaki ifadeyi vermişlerdir.
Burada fA A nın aktivite katsayısı, ZA
A'nın yükü; m çözeltinin iyonik şiddeti, ve aA
hidratize iyonun etkin çapı (angstrom) dır. 0.5085 ve 0.3281 sabitleri 25 0C'
deki çözeltiler için kullanılabilir; sıcaklığın farklı olması halinde başka
değerler gerekir. Tablo-1'de çeşitli deneysel çalışmalarla, çeşitli iyonlar
için hesaplanmış aA ve (4).
denklemden bulunan aktivite katsayıları verilmiştir.
Debye-Hückel bağıntısı ve Tablo-1'deki veriler iyonik
şiddetin 0.1'e kadar olduğu değerler için tatmin edici aktivite katsayıları
elde edildiğini gösterir; 0.1'den büyük değerlerde denklem yetersiz kalır.
Böyle durumlarda deneysel olarak saptanan ortalama aktivite katsayıları
değerleri kullanılmalıdır. Elektrokimyasal hesapların çoğu, deneysel olarak
aktivite katsayısı tayinleri yapılamayan yüksek iyonik şiddeti çözeltilerle
yapılmak zorunluluğundadır. Bu gibi hallerde zorunlu olarak aktivite yerine
konsantrasyon değerleri kullanılır. Hesaplarda yüzde bir kaç seviyesinde
şüpheli sonuçlar alınır.
Hücre potansiyellerine konsantrasyonun (veya aktivite)
etkisi Şekil-2'deki hücre ile açıklanabilir. Hücre, konsantrasyon terimleri ile
aşağıdaki gibi yazılır.
Bu reaksiyonun denge sabiti,
[H+] ve [Cl-], hidrojen ve klorür
iyonlarının konsantrasyonları, pH2 hidrojenin atmosferdeki kısmi
basıncıdır. Burada gümüş ve gümüş klorür katı haldedir ve konsantrasyonları
sabittir. Bu nedenle değerleri K sabiti içinde bulunur.
İkinci bir tanımlama Q ifadesi ile yapılabilir.
Buradaki a terimi konsantrasyonların denge konsantrasyonları
değil herhangi bir andaki konsantrasyonlar olduğunu gösterir. Bu nedenle Q bir
sabit değildir, denge konumuna ulaşıncaya kadar sürekli olarak değişir; denge
noktasında, Q = K olur ve a alt terimi
çıkarılır.
Termodinamik bakımdan, bir hücre reaksiyonundaki serbest
enerji değişimi DG
(sabit sıcaklık ve sabit basınçta elde edilebilen maksimum iş)
R, gaz sabiti (8.376 j/mol K), T sıcaklıktır (K); ln, e
tabanına göre logaritmayı gösterir.Aynı zamanda hücre potansiyelinin (Ehücre),
reaksiyonunun serbest enerjisi ile ilişkisi de aşağıdaki eşitlikle
gösterilebilir.
F(96491 coulomb/mol) faraday, n yükseltgenme-indirgenme
reaksiyonundaki alıp verilen elektron sayısı (veya mol elektron) dır. (Bu
örnekte n = 2'dir). (6) ve (8) denklemleri (7)'de yerlerine konularak aşağıdaki
eşitlik çıkarılır.
Tablo-1: İyonların Aktivite Katsayıları, 25 0C’de
İyon
|
Etkin çap, aA, A0
|
Belirtilen iyonik
şiddetlerdeki
aktivite katsayıları, fA |
||||
0.001
|
0.005
|
0.01
|
0.05
|
0.1
|
||
H3O+
|
9
|
0.967
|
0.933
|
0.914
|
0.86
|
0.83
|
Li+, CH3COO-
|
6
|
0.965
|
0.929
|
0.907
|
0.84
|
0.80
|
Na+, IO3-,
HSO3-, HCO3-, H2PO4-,
H2AsO4-, OAc-
|
4-4.5
|
0.964
|
0.928
|
0.902
|
0.82
|
0.78
|
OH-, F-,
SCN-, HS-, ClO3-, ClO4-,
BrO3-, IO4-, MnO4-
|
3.5
|
0.964
|
0.926
|
0.900
|
0.81
|
0.76
|
K+, Cl-,
Br, I-, CN-, NO2-, NO3-,
HCOO-
|
3
|
0.964
|
0.925
|
0.899
|
0.80
|
0.76
|
Rb+, Cs+,
Tl+, Ag+, NH4+
|
2.5
|
0.964
|
0.924
|
0.898
|
0.80
|
0.75
|
Mg+2, Be+2
|
8
|
0.872
|
0.755
|
0.69
|
0.52
|
0.45
|
Ca+2, Cu+2,
Zn+2, Sn+2, Mn+2, Fe+2, Ni+2,
Co+2, ftalat-2
|
6
|
0.870
|
0.749
|
0.675
|
0.48
|
0.40
|
Sr+2, Ba+2,
Cd+2, Hg+2, S-2
|
5.0
|
0.868
|
0.744
|
0.67
|
0.46
|
0.38
|
Pb+2, CO3-2,
SO3-2, C2O4-2
|
4.5
|
0.868
|
0.742
|
0.665
|
0.46
|
0.37
|
Hg2+2,
SO4-2, S2O3-2, CrO4-2,
HPO4-2
|
4.0
|
0.867
|
0.740
|
0.660
|
0.44
|
0.36
|
Al+3, Fe+3,
Cr+3, La+3, Ce+3
|
9
|
0.738
|
0.54
|
0.44
|
0.24
|
0.18
|
PO4-3,
Fe(CN)6-3
|
4
|
0.725
|
0.50
|
0.40
|
0.16
|
0.095
|
Th+4, Zr+4,
Ce+4, Sn+4
|
11
|
0.588
|
0.35
|
0.255
|
0.10
|
0.065
|
Fe(CN)6-4
|
5
|
0.57
|
0.31
|
0.20
|
0.048
|
0.021
|
bu eşitliğin (9)'da yerine konmasıyla E hücre potansiyeli aşağıdaki,
şekilde düzenlenebilir. Standart potansiyel sabittir ve
reaksiyona giren ve reaksiyon sonunda elde edilen maddelerin konsantrasyonları
(daha doğru olarak aktiviteleri) ve basınç 1 olduğunda, hücre potansiyeline
eşit olur. Nernst eşitliği:
Nernst eşitliği ile konsantrasyonun hücre potansiyeli
üzerindeki etkisi saptanabilir.
Aşağıdaki reaksiyon için:
(a) [Cu+2] = 0.3 M, [Fe+2] = 0.1 M
olduğunda hücre potansiyeli nedir?
(b) Aynı hücre, [Cu+2] = 0.3 M olduğunda, Ehücre
= + 0.76 V değerini gösteriyorsa, [Fe+2] ne kadardır?.
Çözüm:
Öncelikle, yarım-hücre reaksiyonları yazılarak E0hücre
değeri bulunur.
(a) [Cu+2] = 0.3 M, [Fe+2] = 0.1 M
değerleri veriliyor.
Nernst eşitliğinden Ehücre hesaplanır.
(b) [Cu+2] = 0.3 M olduğunda,
ÖRNEK.4
Gümüş elektrotlu, anot bölmesinde 0.1 M AgNO3,
katot bölmesinde 1 M AgNO3 çözeltisi bulunan bir hücrenin Ehücre
= ? V
Çözüm:
Her iki bölmedeki gümüş iyonu konsantrasyonu (Ag+) 1M
olsaydı, E01/2 değerleri aynıdır; dolayısıyla, E0hücre
= 0 V’tur.
Demir elektrotlu, anot bölmesinde 0.01 M ve katot bölmesinde
0.1 M Fe+2 çözeltisi bulunan bir hücrenin Ehücre = ? V
Çözüm:
Şekil-7(b)’de verilen galvanik hücrede gümüş iyodürün Ksp
değerinin ölçülmesi.
Çözünürlüğü
az bir bileşiğin Ksp değerinin bulunması
Hücre diyagramı:
Çözüm:
AgI bileşiğinin
Ksp değerinin bulunması.
Hücre için Nernst denkleminden Ag+ iyonlarının
konsantrasyonu bulunur, ve çözünürlük ürünleri eşitliğinden denge sabiti
hesaplanır.
x = doygun gümüş iyodür çözeltisindeki [Ag+]
Doyun AgI
çözeltisinde Ag+ ve I- konsantrasyonları eşit olduğundan,