Çekirdeklerin bulunduğu kimyasal çevre enstrümanın
responsunu etkiler. Bir NMR spektrumdan sinyallerin sayısı, şiddeti, konumu
(kimyasal kayma) ve bölünmeleriyle (splitting) ilgili çeşitli bilgiler
edinilebilir. Her çekirdek tek bir absorbsiyon piki ile tanımlanır, pikin
konumu atomun kimyasal durumuna bağlı değildir.
Magnetik alan (B0) ve frekantaki (n) çok küçük artışların absorbsiyon
değerlerini ölçebilen bir cihazla nükleer absorbsiyon piklerinden birinin
çevresindeki spektral bölge detaylı olarak incelenirse, tek pikin birkaç pikten
oluştuğu görülür; asıl piki oluşturan piklerin konumu ve şiddetleri,
absorbsiyonu yapan çekirdeğin kimyasal çevresine bağlıdır.
NMR spektraya çevresel etkiler iki grup altında toplanabilir:
- Kimyasal
Kayma (Shift): Sinyallarin konumunu gösterir; referans bir sinyale karşı
relatif olarak sinyalin konumuna “kimyasal kayma” denilmektedir.
- Spin-Spin
Bölünmesi (Splitting): Sinyal bölünmesi, bitişik karbon atomlarındaki
proton sayılarını gösterir. Bölünen pikler arasındaki mesafe, eşleşme, J
(kapling) sabiti olarak tanımlanır.
Kimyasal kayma, basit bir örnekle, etanolün düşük
rezolusyonlu bir cihaz ile çizilmiş olan aşağıdaki şekil(a)’da görülebilir.
Spektrumuda; soldan sağa doğru 1:2:3 alan oranlarında üç proton piki vardır. Bu
oranlara göre pikler sırasıyla hidroksil, metilen ve metil protonlarıdır. Üç
absorbsiyon piki protonun absorbsiyon frekansında küçük farklılıklar olduğunu
gösterir. Bu, H atomunun bağlı olduğu gruba göre değişir; bu etki
"kimyasal kayma (shift)"dır.
Spin-spin bölünmesi için, yine etanol örneği incelendiğinde,
etanolün yüksek rezolusyonlu spektrumunda üç proton pikinden ikisinin ilave
piklere bölündüğü görülür. Kimyasal kaymanın üstüne binen bu ikinci etki,
"spin-spin bölünmesi"ndendir. Yapısal analizlerde her iki etki de
önemlidir.
Mutlak alan kuvvetinin yüksek rezolusyonun gerektirdiği
doğrulukta tayin edilebilmesi çok zordur veya olanaksızdır; oysa yardımcı
tarama sarımlarının neden olduğu alan kuvvetindeki "değişme" birkaç
mili gausa kadar ölçülebilir. Bu durumda, rezonans absorbsiyon piklerinin
konumlarını ayni anda ölçülen standart bir maddenin rezonans pikine göre
kıyaslamalı olarak rapor etmek uygun olur. Bu yöntemde magnetik alandaki
düzensizliklerin etkisi en azdır. Bir iç standart kullanılması da avantajlıdır,
çünkü kimyasal kaymalar osilatör frekansından bağımsız olarak kaydedilir.
Çeşitli iç standartlar vardır, fakat en çok kullanılan
tetrametilsilan (TMS), (CH3)4Si dır. Bu bileşikteki tüm
protonlar birbirine eşdeğerdedir, ve TMS'nin kayma parametresi diğer
protonların pek çoğundan daha büyüktür. Bu özellik TMS nin, yüksek bir uygulama
alanında, bir spektrumdaki ilgilenilen piklerin hemen hepsinden daha uzakta tek
ve keskin bir pik vermesini sağlar.
NMR Spektranın Apsis Skalası
NMR grafikleri d değerleri
ile doğrusal bir skala izlerler. Veriler soldan sağa doğru artan alan
akımlarında alınır.
Referans olarak TMS (tetrametilsilan) kullanıldığında, d skalasında TMS piki d = 0 da çıkar ve d nin
değeri sağdan sola doğru artar. Aşağıda verilen iki spektra farklı sabit alanlı
cihazlarda alınmış olmasına karşın çeşitli piklerin ayni d değerlerinde çıktığı görülmektedir.
Spin-spin bölünmesini kaydetmek için miligaus veya hertz
skalası kullanılır. Hertz skalası daha çok uygulanır. Referans TMS pikinin
konumu, sağdan sola doğru artan frekanslarda, sıfır kabul edilir. Böylece, TMS
pikinin çıktığı alan sabit tutulduğunda protonu rezonansa sokmak için gerekli
olan osilatör frekansı artışı ile verilen bir pikin frekansı birbirine eşit
olur.
Şekilde görüldüğü gibi, 60 MHz ve 100 MHz cihazlarda spin
spin bölünmesi, frekans birimleri (J) ile birbirinin aynisidir. "Frekans
birimleri"ndeki kimyasal kayma daha yüksek frekanslı cihazlarda görülür.
NMR spektranın apsis skalaları
KİMYASAL KAYMA
Her çekirdekte karşı alan, dolayısıyla etkin
alanın değişmesine kimyasal kayma denilmektedir.
Aynı izotopun tüm nükleer spinleri, Zeeman etkileşimine ilaveten başka tür
etkileşimler olamadığı durumlarda, aynı rezonans frekansındadır. Oysa frekans,
bir moleküldeki her çekirdeğin, elektron yoğunluğuna (elektron yoğunluğu ise,
yakındaki atomların elektronegatifliğine, bitişik atomların hibridizasyonuna
ve, bitişik p bağlarından diamagnetik etkilere bağlıdır), moleküldeki
kimyasal bağlara ve çekirdek tiplerine bağlı olarak değişir.
Çekirdeği saran elektronların hareketiyle oluşan alan
nedeniyle çekirdek, dış alandan biraz daha küçük (bazen da daha büyük) etkin
bir alanla karşı karşıya kalır; alanın büyüklüğü, uygulanan dış alanla doğru
orantılıdır.
Buyg: B0 'da, çekirdeğin rezonans
davranışını tayin eden sonuç alandır. TMS rezonans hattını çıkaran alan kuvveti
Bref, örneğin verilen bir absorbsiyon piki için Börn ise,
Kimyasal kayma parametresi d,
sörn ve sref : örnek ve referansın koruma (veya perdeleme)
parametreleridir. s çekirdeğin
etrafındaki elektron yoğunluğuna, elektron yoğunluğu da çekirdeğin bulunduğu
bileşiğin yapısına bağlıdır.
Kimyasal kayma parametresi (d), örnek ve
referansın rezonans frekansları nörn ve nref ile gösterildiğinde,
eşitliğiyle
verilir. d boyutsuzdur ve ppm
olarak relatif kaymayı belirtir; verilen bir pik için d, cihazın 60, 90, veya 100 MHz lık olmasından bağımsızdır. (kullanılan
diğer bir kimyasal kayma parametresi t
dur, d = 10 – t)
Çeşitli fonksiyonel gruplardaki protonlarının s’ları
farklı olduğundan gerekli uygulama alanı gruptan gruba değişir. Örneğin,
etanoldeki hidroksil protonu en düşük uygulanan alanda çıkar, sonra metilen
protonları, daha sonra da metil protonları görülür. Burada iki önemli noktayı
belirtmek gerekir:
·
Herhangi bir gruba bağlı olmayan teorik bir
hidrojen çekirdeği için hesaplanan uygulama alanı, NMR spektrumun en solunda
bir noktadadır, ve etanole ait üç pik için de bundan daha büyük uygulama
alanları gerekir.
·
Uygulanan alanın, metil protonunu uyaracak bir
seviyede sabit tutulması durumunda metilen protonlarını rezonansa sokabilmek
için frekansın artırılması gerekir.
Diamagnetik Akımların
Etkisi
Daha önce açıklandığı gibi, kimyasal kayma moleküldeki
elektronların akımlarıyla (dolaşmalarıyla) üretilen ikincil magnetik alanlardan
meydana gelir. Bu elektronik akımlar (yerel "diamagnetik akımlar")
sabit magnetik alandan etkilenerek, bir protonu belirleyen alanı azaltan veya
yükselten ikincil alanlar oluştururlar.
Protona bağlı elektronlar magnetik alanın etkisi altında,
magnetik alana dik bir düzlem içinde, çekirdeğin etrafında dolaşırlar. Bu
hareketin sonunda dış (birincil) alanın zıt yönünde bir ikincil alan doğar;
buradaki olay elektronların tel bir luptan geçişine benzer. Böylece çekirdek,
daha küçük olan alanın etkisine girer ve dış alana karşı korunur; nükleer
rezonansın oluşması için, sonuçta, dış alanın artırılması gerekir.
Elektronların hareket frekansı, ve buna bağlı olarak da ikincil alanın
büyüklüğü, dış alanın kuvveti ile doğru orantılıdır.
Bir çekirdeğin diyamagnetik korunması
(shielding)
Verilen bir çekirdeğin karşılaştığı korunma, onu saran
elektron yoğunluğuna bağlıdır. Diğer etkenlerin bulunmadığı bir durumda,
çekirdeğe bağlı diğer grupların elektronegatif özelliklerinin artmasıyla korunma
da azalır. Bu etki metil halidlerdeki (CH3 X) protonların d değerleri ile açıklanabilir.
En az elektronegatif olan I protonlardan elektronları en zor
çeker; böylece iyodun elektronlarının korunma etkisi en fazladır. Benzer
şekilde, metanolün metil protonlarının etrafındaki elektron yoğunluğu, oksijene
bağlı olan protonun etrafındaki elektron yoğunluğundan daha fazladır, çünkü oksijen
karbondan daha elektronegatif bir elementtir. Bu durumda metil pikleri
hidroksil piklerinden daha yüksek alanda çıkarlar. Silikon oldukça
elektropositif bir element olduğundan TMS'deki proton piklerinin konumu bu
modelle de açıklanabilir. Asidik protonun elektron yoğunluğunun çok düşük
olması nedeniyle, RSO3H veya RCOOH daki proton piki çok düşük alanda
çıkar (d > 10).
Elektronegatiflik
Magnetik
Anizotropinin (non-uniformity) Etkisi
Çift veya üçlü bağlar içeren bileşiklerin spektrasındaki
bazı proton piklerinin konumları yerel diamagnetik etki ile açıklanamaz.
Örneğin, artan asidite (veya protonların bağlı olduğu grupların artan
elektronegativite) özelliklerine göre sıralanan aşağıdaki hidrokarbonlardaki
protonların değerleri düzensiz bir durum gösterirler:
Bitişik Atomların Hibridizasyonu ve
p-Bağlarının Diamagnetik Etkisi
p-Bağlarının Diamagnetik Etkisi
Aldehit protonu RCHO (d ~10)
ve benzen protonu (d ~ 7.3), bunların
bağlı oldukları grupların elektronegatiflik özelliklerine göre bulunmaları
gereken alandan çok daha düşük değerlerde çıkarlar.
Bu durum iki veya üçlü bağların kimyasal kaymada etkili
olduğunu gösterir; etkiler bu tip bileşiklerin anizotropik magnetik
özellikleriyle açıklanır.
Benzen Halkasındaki
Protonlar
Bunun için önce "magnetik hassasiyet" ifadesini
açıklayalım: Bir maddenin magnetik hassasiyeti bir dış alan tarafından tesirle
magnetik hale getirilebilme kolaylığı olarak tarif edilir. Kristal aromatik
bileşiklerin magnetik hassasiyetleri, aromatik halkanın uygulanan alana göre
olan konumuna (yönüne) göre önemli derecede değişir. Bu anizotropi şekildeki
modelden açık olarak görülmektedir. Burada aromatik halka düzlemi magnetik
alana diktir; bu konumda alan p elektronları
etkileyerek halkanın etrafında dönmesine neden olur (bir halka akımı). Sonuç
bir tel lupda oluşan akıma benzer; uygulanan alana zıt yönde hareket eden
ikincil bir alan oluşur. Bu ikincil alan halkaya bağlı protonlara uygulanan dış
alanla ayni yönde bir magnetik etki de yapar. Bu durumda, aromatik protonların
rezonans haline getirilmesi için düşük bir dış alana gerekir. Bu etki halkanın
alana göre diğer konumlarında ya hiç bulunmaz veya kendi kendini yok eder.
Halka akımı ile aromatik protonların
korunmadan çıkması (deshielding)
Karbon-Karbon Çift
Bağlardaki Protonlar
Etilenik çift bağı için de benzer bir model
şekillendirilebilir. Molekül alana göre, şekildeki gibi bir konumda bulunursa, p elektronların bağ ekseni düzleminde dolaştığı
düşünülür; oluşan ikincil alan protona etki ederek uygulanan alanı kuvvetlendirir.
Böylece korunmanın bozulmasıyla pik daha yüksek d
değerine kayar.
Elektronik akımlar sonucu etilende
korunmanın kalkması (deshielding)
Karbon-Oksijen Çift
Bağlardaki Protonlar
Bir aldehit molekülünde bu etki, karbonil grubunun
elektronegatif yapısından kaynaklanan etki ile birleşir ve sonuçta çok büyük d değerlerine çıkılır.
Karbon-Karbon Üçlü
bağdaki Protonlar
Asitilenik bir bağda, bağ eksenindeki simetrik p elektronların dağılımı, elektronların bağ
etrafında dolaşmalarına yol açar (tersine, bir çift bağın elektron dağılımındaki
hareketsiz düzlem böyle bir dolaşmayı engeller). şekilde bu düzenlenmede
protonların kaydırıldığı görülmektedir. Bu etki, protonların asiditesinden ve
bağın dik konumundan oluşan elektronik akımların etkisini (korunmanın kalkması)
yok etmeye yetecek kadar büyüktür.
Asetilende korunma (shielding)
oluşması
Kimyasal Kayma
(Shift) ile Yapının İlişkisi
Kimyasal kayma fonksiyonel grupların tanımlanmasına ve grupların
yapısal düzenlenmelerinin açıklanmasında kullanılır. Bu uygulamalar yapı ve
kayma arasındaki deneysel ilişkilere dayanır. d
'nin gerçek değeri madde konsantrasyonuna olduğu kadar solventin
yapısına da bağlıdır.
Bu konuda çeşitli şekillerde düzenlenmiş ilişki grafikleri
ve tabloları hazırlanmıştır. Çeşitli
yapısal ortamlarda protonun absorbsiyon konumlarını gösteren ilişki çizelgeleri
ve tablolar hazırlanmıştı. Aşağıda, örnek olarak iki ilişki çizelgesi ve bir tablo
verilmiştir.
Bazı
Grupların 1H NMR Kimyasal Kayma Aralıkları
SPİN-SPİN BÖLÜNMESİ (SPLITTING)
Spin-Spin Splitting (Bölünme): Aynı veya bitişik karbondaki eşdeğer olmayan protonlar
arasındaki magnetik etkileşim nedeniyle piklerin, çoklu piklere bölünmesidir.
Spin-Spin Kapling (Eşleşme): İki proton birbirinin pikinin çoklaşmasına (split) neden
oluyorsa, bu iki proton eşleşmiştir (kapıld). Eşleşmiş protonlar birbirinin NMR
sinyalinin bölünmesine neden olurlar. n tane bitişik protonun kaplingi bir
sinyali n+1 pike böler.
Kapling Sabiti, J, Hz: Sinyalin bölünme ölçüsüdür; bir çoklu pikler (veya bölünen
pikler) arasındaki mesafeye kapling sabiti denir. J’nin büyüklüğü, sadece bir moleküldeki magnetik atomların
neden olduğu alanlara bağlıdır, fakat dış alanın (B0) gücünden bağımsızdır.
Spin-Spin
Splitting Koşulları
1. Eşdeğer protonlaın birbirleri üzerinde splitting etkisi yoktur. Metil
klorürde üç C¾H
protonu, 1,2-dikloroetanda ise dört C¾H protonu kimyasal olarak birbirleriyle eşdeğerdir; her iki
molekülde de splitting olmaz.
2. Bir molekülde protonların birbirlerinden uzaklıkları iki karbon atomu arasındaki mesafeden daha fazla olduğunda, birbirlerine split etkisi yapmazlar. Aşağıdaki iki örnekten birincisinde splitting gözlenirken, ikincisinde genellikle splitting yoktur.
4. Bir molekülde, protonlar birbirlerinden 3 s bağından daha fazla sayıda s bağıyla ayrılıyorsa, genellikle splitting gözlenmez. 2-Bütanon ve etil metil eterde Ha ve Hb arasında 4 s bağı bulunduğundan, her iki molekülde de splitting olayı yoktur.
n + 1 Kuralı: Bir hidrojene bitişik atomda (veya
atomlarda), kendisiyle eşdeğer-olmayan, fakat kendi aralarında eşdeğer olan n
tane hidrojen bulunuyorsa, bu hidrojenin sinyali n+1 adet pike bölünür. Spinleri
(I) ½’ den farklı olan çekirdekler için çoğalma (2nI+1) sayısına eşittir. Bir
çoğalmanın relatif alanları bandın orta noktasına göre simetriktir ve (x+1)n formülünün açılmasıyla elde edilen katsayılarla
orantılıdır. Bu kuralın genel şeması aşağıdaki tabloda verilmiştir.
Bir çekirdek, farklı J değerlerindeki iki veya daha fazla
komşu çekirdekle spin-kapling yaparsa, siplittig paternin tamamı n+1 kuralına
uymaz; bir J değeri için olan splittingler, diğer bir J değerindekilerden
etkilenerek farklı splitting şekilleri verirler.
Örneğin, alkenil protonlarının splittinginde, yakındaki bir
proton, sinyali bir dublete bölerken, ikinci yakın proton, dubleti, dubletlerin
dubleti halinde böler.
Aşağıda, ikinci-derece spektra olarak yorumlanan bazı
komplike spektra örnekleri verilmiştir.
ÖRNEK. 1
Br2CHCH2Br
(1,1,2-tribromoetan)
Dublet pik grubu
Moleküldeki CH2 grubunun neden olduğu dubletin
oluşum mekanizmasını inceleyelim. Bir magnetik alana (B0)
konulduğunda CH2 grubuna bitişik karbondaki proton (CHBr2),
B0. ile ayni yönde () veya ters yönde (¯) yer alır. Bu durumda CH2 protonları biri B0’dan
biraz daha büyük ve diğeri B0’dan biraz daha küçük olan birbirinden
çok az farklı iki magnetik alan algılar; absorbsiyon yapan protonlar NMR
spektrumda iki farklı frekansta absorbsiyon yapar. Sonuçta tek absorbsiyon,
eşit şiddetlerde iki pike (bir dublete) bölünür.
Triplet pik grubu
Bitişik karbon atomlarındaki Ha ve Hb,
bir magnetik alan (B0) uygulandığında, alan ile ayni () veya zıt (¯) zıt yönde
yönlenir. Absorbsiyon yapan proton birbirinden çok az farklı üç magnetik alan
algılar:
Absorblayan proton, üç farklı magnetik alan algıladığından
üç farklı frekansta absorbsiyon yapar; dolayısıyla, tek absorbsiyon piki üçe
(triplet) bölünür.
ÖRNEK. 2
CH3¾CH2¾OH (etanol)
Metil grubundaki protonlar, yukarıdaki 1,1,2-tribromoetan
örneğinde anlatıldığı gibi, metilendeki iki proton nedeniyle bir triplet pik
grubu gösterirler. Alan oranları 1:2:1 dir.
Metilen bandının çoğalmasını, bitişik metil grubundaki üç
proton tayin eder. Bir moleküldeki iki metilen protonunun (¾CH2¾) dört olası spin
hali vardır ve tüm örnek içinde bu bileşimlerin her biri eşit olarak temsil
edilirler; pik alan oranları 1:3:3:1 olan dört pike ayrılır. Burada sekiz olası
bileşim vardır; bunlardan üçlü bileşimlerden ikişer grubun magnetik etkileri
birbirine eşittir; metilen piki alan oranları 1:3:3:1 olan dört pike ayrılır;
bir kuartet meydana gelir.
(Etanoldeki OH protonu (çok saf etanol hariç), genellikle,
bitişiğindeki protonların NMR sinyalini bölmez, bitişik protonlar da alkol OH
sinyalini bölmezler; n=0.)
Kompleks Spin-Spin Splitting
Paternleri
Işın absorblayan proton, bulunduğu karbon atomuna bitişik
iki (veya daha fazla) karbon atomundaki eşdeğer olmayan protonlarla
eşleştiğinde (kapıld) kompleks splitting meydana gelir.
ÖRNEK. 1
BrCH2CH2CH2Br
(1,3-dibromopropan)
Protonun bulunduğu karbon atomuna bitişik karbon
atomlarındaki eşdeğer olmayan protonlar birbirleriyle eşdeğerlerse n+1 kuralı
hala geçerliliğini korur.
Molekülün iki ucundaki dört eşdeğer protonun grup bandı
sayısını merkez karbondaki protonlar (iki tanedir) belirler; buna göre,
uçlardaki CH2 grupları için:
Merkez karbondaki iki metilen protonunun çoğalma sayısını da
uçlardaki eşdeğer dört proton saptar:
(x + 1)4 formülünün açılmasıyla 1:4:6:4:1
katsayıları bulunur ve pik alanları bu katsayılarla orantılıdır.
ÖRNEK. 2
CH3 CH Br CH3
(2-bromopropan)
2-Bromopropanda Hb’ye bitişik karbon
atomlarındaki Ha ile gösterilen eşdeğer olmayan protonlar
birbirleriyle eşdeğerlerdir; dolayısıyla n+1 kuralı geçerlidir.
İki metil grubundaki altı metil protonu, merkez karbondaki
proton sayısı n = 1 olduğundan,
Merkezdeki karbon atomuna bağlı bir proton için de uçlardaki
6 proton nedeniyle (n = 6), 7 pikli bir grup bandı oluşur.
bu piklerin alanları (x+1)6 nın açılımıyla,
ÖRNEK. 3
CH3CH2CH2OCH2CH2CH3
(Dipropileter))
Dipropilterde Hc ile eşdeğer olmayan, Hc’ye
bitişik karbon atomlarındaki Hb protonları, ve Hb ile
eşdeğer olmayan Hb’ye bitişik Ha ve Hc
protonları kendi aralarında eşdeğerdir; moleküldeki çekirdekler için n+1 kuralı
uygulanabilir.
ÖRNEK. 4
CH3 CH2
CH2¾Br (1-bromopropan))
Metilen protonları (Hb) bandı, J(ab) ve J(bc) arasındaki fark nedeniyle, magnetiklikleri eşdeğer olmayan iki grup protonun etkisi altındadır; protonun (burada Hb) bulunduğu karbon atomuna bitişik bir karbon atomunda n tane ve diğer bitişik karbon atomunda da m tane eşdeğer olmayan protonlar bulunması halinde n+1 kuralı uygulanamaz; kapling sonucu sinyal, (n+1)(m+1) pike bölünür.
1-bromopropandaki Ha, Hb, Hc
prtonları için pik sayıları:
Aşağıdaki şekil(a)’da 1-bromopropanın Hb protonları için
splitting (bölünme) diyagramı verilmiştir; görüldüğü gibi sinyal, 12 pike
ayrılır; bölünme tripletlerin kuarteti şeklindedir. (Çoklukların
çoklukları, veya multipletlerin multipletleri)
Piklerin sayısı, kapling sabitleri Ja ve Jb’nin relatif
büyüklüğüne bağlı olan sinyale göre belirlenir. Ja ve Jb
birbirine yakın değerlerdeyse, pikler üst üste düşer ve daha az sayıda pik
gözlenir (Şekil b ve c);
ÖRNEK. 5
CH2CHOOCCH3 (vinil asetat)
Dubletlerin dubleti splitting (bölünme): İki proton
birbirinin bölünmesine neden olduğunda, eşleşme (kapling) meydana gelir.
Alkenil protonlarının splitting paternleri birbirlerinden
farklıdır; bunun nedeni, kapling sabitlerinin büyüklüklerinin farklı
olamasıdır.
Aşağıdaki şekilde vinil asetatın alkenil protonlarının
splitting diyagramı verilmiştir; görüldüğü gibi, yakındaki bir proton, sinyali
bir dublete bölerken, ikinci yakın proton, dubleti, dubletlerin dubleti halinde
böler.
ÖRNEK. 6
C6H5CH=CH2 (stiren)
Stirendeki Ha sinyali Hb ile kaplin (Jab = 17 Hz)
yaparak, ve sonra Hc ile kapling sonucu (Jac = 11 Hz) bir kez daha
bölünür.
Stirendeki Hb protonu Ha ile kaplin
(Jab - 17 Hz) yaparak bölünür, ve sonra Hc ile kapling (Jbc = 1.4 Hz)
sonucu bir kez daha bölünür.
Kimyasal Yer
Değiştirmenin Spektraya Etkisi
Kimyasal yer
değiştirmen NMR spektraya etkisini etanolün spektrumu üzerinde açıklayalım:
Etanolün 1H NMR spektrumu
Spektrumdaki OH
protonunun bitişiğindeki ¾ CH2 ¾ nedeniyle bir üçlü (triplet)
grup piki vermesi beklenirken neden tek (singlet) bir pik görülür?
Metilen protonları ve OH protonları arasında sadece üç tane
bağ vardır; OH ve metilen piklerinin sayısını artıracak, yani grup pikleri
oluşturacak eşleşme olayı gerçekleşmelidir.
Gerçekte, çok saflaştırılmış bir alkol örneği ile
çalışıldığında şekil(b)’de görüldüğü gibi bir spektrum elde edilir; burada,
beklenen üçlü OH pikleri ve metilenin sekizli grup piki gözlenebilmektedir. Saf
örneğe eser miktarda bir asit veya baz ilave edildiğinde spektrum tekrar şekil(a)'daki
görünümüne dönüşür.
OH protonlarının alkol molekülleri arasındaki yer
değiştirmesinin ortamda bulunan safsızlıklarla olduğu kadar asitler ve bazlarla
da katalizlendiği (artırılır) bilinmektedir. Bu katalistlerin varlığı durumunda
dekapling olur (veya eşleşme bozulur). Yer değiştirme hızlı ise, her OH grubu
kısa bir süre ile birkaç tane protona sahip olur; bu süre içinde, OH
protonlarının hepsi metilen protonlarının üç spin düzeninin etkisinde kalırlar.
Böylece alkolik protondaki magnetik etkilerin birbirini ortalamasıyla keskin ve
tek bir pik oluşur. Yer değiştirme frekansı, etkileşen bileşikler arasındaki
ayrılma frekansından daha büyük olursa, daima spin dekapling olayı ile
karşılaşılır.
Kimyasal yer değiştirme sadece spin-spin spektrasını değil,
kimyasal kayma spektrasını da etkiler. Saflaştırılmış alkol-su karışımları iyi
tanımlanmış ve kolaylıkla ayrılabilen iki OH proton piki verirler. Katalist
olarak bir asit veya baz ilave edildiğinde, iki pik birleşerek keskin tek bir
hat şekline dönüşür. Burada katalist, alkol ve su arasındaki protonun yer
değiştirme hızını artırarak korunma etkisini ortalama bir düzeye getirmiştir.
Yer değiştirme hızı alkol ve suyun kendi hatlarının ayrılma frekansından biraz
daha büyük olduğunda tek bir keskin hat elde edilir. Diğer taraftan, yer
değiştirme frekansının bu frekans farkı ile aynı olması durumunda korunma
etkisi ancak kısmen ortalanabileceğinden geniş bir hat çıkar. Hat genişliğinin
yer değiştirme hızı ile olan ilişkisi, bu tür işlemlerin kinetikleri ile bağıntılıdır
ve NMR ın önemli bir uygulama alanıdır.
İkinci Derece Spektra
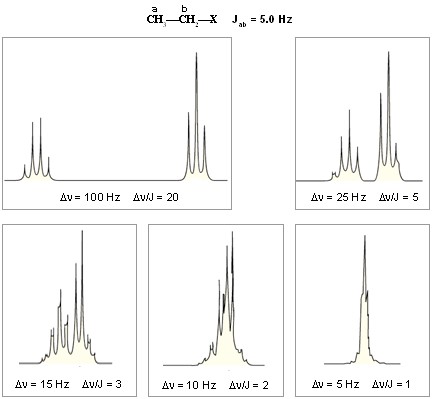
Dn/J nin 7'den küçük
olması durumunda birinci derece spektra için geçerli olan kurallar geçerliğini
kaybeder, n+1 kuralı uygulanamaz. Dn'ün
J'ye yaklaşmasıyla iki grup pikinin iç kısmındaki pikler, dıştaki piklerin
alanlarından harcayarak büyürler, ve tabii bu durumda grup piklerinin simetrisi
de bozulur. Böyle bir spektrumun analizi oldukça zorlaşır.
İkinci
derece spektra J değerlerinin kıyaslamasına dayanan geleneksel metotlarla
analizlenemez. Bazı basit paternler deneyimli kişilerce anlaşılabilir ve
tanımlanabilirse de, çok kompleks spin sistemleri ancak spektral simülasyon
programlarıyla aydınlatılabilir; örneğin, tahmin edilen çeşitli J değerleri ve
kimyasal kayma farklarından yararlanılarak teorik bir spektrum elde edilebilir.
Bazı tanımlar
Her farklı
proton A, B, C, .. harfleriyle gösterilir.
- Protonlar kimyasal ve magnetik
olarak eşdeğerse, A2, B2, .. gibi işaretlenir.
- Protonlar kimyasal olarak
eşdeğer, fakat magnetik olarak eşdeğersizse AA’, BB’, ile tanımlanır.
Bir çift
protonun kimyasal kayması birbirinden çok farklıysa tanımlamada X, Y Z harfleri
kullanılır. Üçlü protonlar grubu durumunda, M, N, ..ara harfkerle işaretleme
yapılır.
İkinci derece spektrada önemli etkenler
- Magnetik
eşdeğersizlik.
- Kapling
yapan protonlar arasındaki kimyasal kayma (n)
farkının, kapling sabitine (J) yakın değerlerde olması.
Dn/J değerleri
- Dn/J > 10 olduğunda, bölünme paterni
birinci derecedir; bu durumda iki protonun eşleşmesi (kaplingi) zayıftır.
- Dn/J < 10 olduğunda ise, bölünme
paterni ikinci derece haline gelir; bu durumda iki proton arasındaki
kapling kuvvetlenir.
ÖRNEK. 1
(a) İki yakın (komşu) proton vardır. J
= 7 Hz. Dn/J büyükse, birinci derece bir
spektrum elde edilir. Spin sistemi AX tir, ve kapling zayıftır (kimyasal
kaymaya göre). Sonuç: İki dublet.
(b) Dn/J küçüldükçe ikinci derece
etkinleşmeye başlar; kapling enerji seviyeleri kimyasal kaymalarla örtüşmeye
başlar.
Spin
sistemi “AB” dir ve kapling kuvvetlenmeye başlamıştır. J = 7 Hz değeri korunmaya
devam eder.
ÖRNEK. 2
AX2, AB2 Spin
Sistemleri
|
(a) Dn/J büyük olduğunda, birinci derece
spektrum elde edilir. Sonuç: Bir dublet ve bir triplet.
(b) Dn/J
değeri düştükçe ikinci derece davranışı gözlenmeye başlar.
Spin
sistemi: AX2, AB2 şekline döner.
ÖRNEK. 3
(b) Dn/J
değeri düştükçe ikinci derece davranışı gözlenmeye başlar.
ÖRNEK. 4
|
|
Etilbenzen Spektrumunda Spin Sistemi
Metil (CH3) grubunun kapling paterni A3X2 formundadır; bir AX2 multiplete benzer, dolayısıyla birinci derece spektrum görünümündedir: Triplet.
Benzer şekilde metilen (CH2) grubu da A2X3
formundadır; bu ise AX3 ile eşdeğerdir. Gruplar spektrumda geniş bir mesafeyle
ayrıldıklarından birinci derece bir görünüm verirler: Kuartet.
Aromatik sinyaller birbirlerine çok yakındırlar; ikinci
derece etkiler ortaya çıkar. Meta ve para sinyaller triplet şeklindeyken, orto
sinyali bir dublettir.
NMR kapling bilgilerinin açık bir şekilde görülebilmesinde
spektrometrenin alan kuvvetinin çok etkilidir. Etil benzen spektrumunun, farklı
alan kuvvetlerinde, sabit Hz skalasında alınmış spektrumunun aromatik sinyaller
bölgesi aşağıdaki şekilde verilmiştir; sinyaller 60 MHz’de hemen hemen bir
singlet görünümündeyken 600 MHz’de bir pikler takımı şeklini almıştır.
Bir Etil Grubunun, Dn/J
Oranının Fonksiyonu Olarak Splitting Paterni
Kompleks Spektranın
Analizinde Yardımcı Yöntemler
Magnetik Alanın
Artırılması
Magnetik alanın artırılması kimyasal kaymaları yükseltir,
fakat kapling sabitlerini etkilemez. Bu durumda, tanımlanamayan kuvvetli bir
magneti bulunan bir cihazla bir ikinci derece spektranın etkileri en aza indirgenir,
birinci derece analize dönüştürülebilir; örneğin, bir triplet ve bir kuartet
içeren bir spektrum, J = 7.5 değeri değişmediği halde 100, 200 MHz cihazlarda
aşağıdaki gibi bir görünüm verir.
İzotopik Sübstitüsyon
Bir moleküldeki bir veya daha fazla protonun yerine
deutöryum substitue edilerek bu protonlara ait absorbsiyon piklerinin
kaybolması sağlanır. Ayrıca bir deutöryum ile bir proton arasındaki kapling,
iki proton arasındaki kaplinge göre çok zayıf olduğundan spektra daha da
basitleşir.
Spin Dekapling (Eşleşmenin
Bozulması)
Spin-spin dekapling, diğer çekirdek tarafından yaratılan
rezonans bölünmesini yok eder. Böyle bir durumda spektra basitleşir,
multipletler singletlere dönüşür, hangi rezonansın hangisiyle eşleştiği bilgisi
edinilir. Ayrıca, sinyal/gürültü oranı yükselir. Bu avantajların yanında
eşleşmenin bozulmasının çoklu yapı ile kapling sabiti bilgisi kaybolması gibi
bazı dazavantajları da vardır. Dekapling proseste örnek, 40-70 MHz aralığındaki
geniş bir yüksek şiddetteki radyo frekansıyla karşılaştırılır; tarama, ~15 MHz
dolayındaki frekanslarda normal şiddetlerde yapılır. Bu koşullar altında tüm
protonlar doyurulmuş olduğundan 13C ile kapling yapamazlar.
Etil fenilasetatın proton-kapıld ve proton-de kapıld 13C NMR
spektrumları:
(b)’de, her karbon atomu tek bir sinyal elde edilmiştir.
(Bazı cihazlar dekapıld spektrada piklerin çokluk sayılarını da gösterir;
şekil(b)’ de s: singlet, d: dublet, t: triplet, k: kuated spin bölünme
şekilleri de verilmiştir.)
Proton-dekapıld spektranın tanımlanması kolaydır, ancak
spektradan edinilebilecek pek çok bilgi kaybolur (her bir karbon atomundaki
bağlı hidrojenlerin sayısının görülememesi gibi). Daha ileri bir teknik olan
off-rezonans tekniğinde, hala kolay tanımlanabilen spektrumlar alınabildiği
gibi, bilgi kaybı da giderilir; off-rezonanas dekapıld spektrumda her
karbondaki proton sayıları görülebilmektedir.
2-Bütanolün proton-kapıld ve proton-de kapıld 13C NMR
spektrumları:
Kimyasal Kaydırma
Reaktifleri (Maddeleri)
Proton NMR spektranın yorumlanmasında "kaydırma
reaktifii" denilen maddelerden çok yararlanılır. Bunlarla bazı
bileşiklerin absorbsiyon pikleri daha büyük bir frekans aralığına yayılır.
Böylece üst üste düşen pikler birbirinden uzaklaşarak ayrılırlar ve tanımlama
kolaylaşır.
Kaydırma maddeleri olarak, çoğunlukla europyum ve
praseodymiyum kompleksleri kullanılır. Birer örnek, aşağıda formülü verilen praseodymiyum(III)'ün
ve europyum(III)’ün dipivalomethanato kompleksleridir [Pr(DPM)3 ve
Eu(DPM)3].
Bu nötral komplekslerdeki praseodymiyum veya europyum iyonu,
yalnız olan elektron çiftleri ile etkileşerek koordinasyonunu artırma
özelliğindedir. Bu özellik nedeniyle kompleks, serbest elektron çiftleri içeren
oksijen, ve diğer atomların bulunduğu moleküllerle reaksiyona girer.
Europyumun veya praseodymiyumun DPM kompleksleri, CCl4,
CDCl3 ve C6D6 gibi polar olmayan solventler
içinde kullanılır; böylece, metal iyonu üzerindeki elektron alıcıya karşı
solventin analite rakip olması önlenir.
Aşağıdaki şekilde stiren oksitin karmaşık spektrumuna
Pr(DPM)3'ün etkisi görülmektedir. Burada oksijenin bağlı olduğu
kısımlara en yakın olan hidrojenler daha yüksek alanlara (TMS referansının da
üstünde) kaydırılmıştır. Halkadaki orto-hidrojen de, metal iyona daha yakın
olduğundan, m- veya p-hidrojenlerden daha yüksek alanlara çıkarılmıştır.
Stiren oksidin NMR spektrumuna Pr
(DPM)3 ün etkisi; A: kaydırma reaktifi bulunmadığı durum, B:
kaydırma reaktifi bulunduğu hal
Eu(DPM)3 ile de benzer etkiler gözlenir, sadece
kaymalar biraz daha düşük alanlarda olur. Bunda da en çok etkilenen protonlar
metal iyonuna en yakın olanlardır.
Kimyasal kaymanın en önemli kaynağı, paramagnetik praseodymiyum
veya europyum iyonlarının büyük magnetik momentlerinin yarattığı ikincil
magnetik alandır. Analit ile kaydırma reagenti arasındaki kompleksin geometrisi
bilinirse, analitteki çeşitli protonların kayma mesafesiyle ilgili mantıklı
tahminler yapılabilir.