Absorbsiyon ve
Emisyon
Vakumdan gelerek bir maddenin yüzeyleri arasına giren ışının
elektriksel vektörü, ortamda bulunan atom ve moleküllerle etkileşerek maddenin
özelliklerine göre geçer, tutulur veya saçılır.
Elektromagnetik ışın ortamdan çok büyük hızlarda geçen bir
enerji tipidir, geniş bir dalga boyu (enerji) aralığını kapsar. Frekanslarına
bağlı olarak madde ile etkileşimleri farklı olur; oda sıcaklığında etki termal
enerji şeklinde olurken çok yüksek frekanslarda iyonlaştırıcı özellikler
gösterir.
İyonizasyon Bölgesi: İyonizasyon bir atomu bozarak
kimyasal aktif bir iyon meydana getirir. Molekülde ise molekülü oluşturan atomu
bozarak molekülün özelliğini kaybetmesine neden olur.
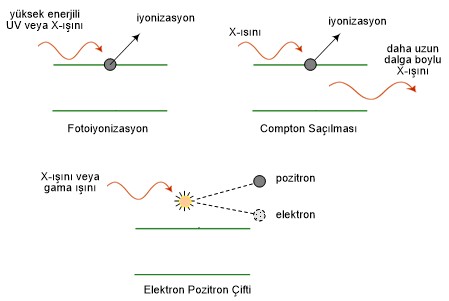
Bu bölgedeki etkileşim mekanizmaları, X-ışınları ve gama
ışınları için, fotoelektrik etki, Compton saçılması ve yeteri kadar yüksek
enerjilerde elektron pozitron çiftinin üretilmesidir. Ayrıca, UV fotonları da,
iyonizasyon enerjisinin üstünde atomları ve molekülleri bozucu bir etkileşim
yapar.
Gama ışılarının
enerjisi X-ışınlarından biraz daha yüksektir; bu nedenle de ancak kurşun
levhalarla tutulabilir,.daha giricidir.
Şekil-1: a, b ve
g
ışınlarının giricilikleri
Non-iyonizasyon Bölgesi: Non-iyonize ışın atom veya
molekülü bozmaz; mikro saniye veya daha kısa bir sürede, molekülde kalıcı bir
değişiklik olmaksızın, en düşük enerji seviyesine geri dönülür. İyonizasyon
enerjisinin altındaki UV fotonları, elektron geçişi meydana getirerek kuvvetle
absorblanırlar. Görünür ışın da elektron geçişine neden olur. Infrared ışın ise
molekülleri titreştirir.
Mikro Dalgalar ve
Radyo Frekansları: Mikro dalgalar moleküler dönme (rotasyon) ve bükülme
(torsion) hareketlerine neden olurken radyo frekansları için geçerli olan
moleküllerin değişken polarizasyonu ısınmayı artırır.
Görünür ve ultraviyole ışınların madde ile
etkileşimlerindeki elektron geçişleri örnek olarak alındığında, bir fotonun
absorbsiyonu ancak, fotonon kuvantum enerjisinin, ilk ve son haller arasındaki
enerji miktarı ile aynı (çok yakın) olması halinde gerçekleşir.
Absorbsiyon koşulu:
DE
= hn = E2 – E1
Aşağı doğru geçiş, enerji fotonunun emisyonu ie gerçekleşir:
Efoton = hn = E2 – E1
IŞININ ABSORBSİYONU
Şeffaf olan katı, sıvı, veya gaz gibi tabakalardan geçen
ışındaki bazı frekanslar, absorbsiyon olayı sonucunda, seçimli olarak
tutulurlar. Burada örneği oluşturan atomlar veya moleküllere elektromagnetik
enerji transfer edilir; tanecikler düşük bir enerji halinden daha yüksek enerji
hallerine veya "uyarılmış hallere" geçerler. Oda sıcaklığında
maddelerin çoğu en düşük enerji seviyesindedirler. Bu, "temel
hal"dir. Absorbsiyon, taneciklerin temel halden, yüksek enerjili hallere
geçmesiyle ilgilidir.
Atomlar, moleküller veya iyonların belirli sayıda enerji
seviyeleri vardır. Işının absorblanması için uyarıcı fotonun enerjisinin,
absorblayan taneciklerin temel halleri ve herhangi bir uyarılmış hali
arasındaki enerji farkına eşit olması gerekir. Bu enerji farkları her tanecik
için ayrı ve karakteristik olduğundan ışının örnek tarafından absorblanan
frekansları, örnekte bulunan atom, molekül veya iyonların tanımlanmasında
kullanılır.
Bu amaçla, absorbans değerinin dalga boyu veya frekansa göre
grafiği çizilir. Buna, "absorbsiyon spektrumu" denir. Spektrumunun
görünümü absorblayan türlere, fiziksel haline ve ortama bağlıdır.
Spektrumlar iki grupta toplanabilir:
- Atomik
absorbsiyon
- Moleküler
absorbsiyon
Şekil-2: Tipik
bazı organik bileşiklerin UV absorbsiyon spektrumu
Şekil-3: 1,2,4,5-tetrazinin görünür (visible) absorbsiyon spektrumları
Atomik Absorbsiyon
Atomik spektroskopide ilk aşama örneğin gaz haline geçmesini
sağlayacak şekilde atomize edilmesidir. Bunun için örnek uygun bir çözücü içinde
aleve tutulur ve çok az miktarın atomize olması sağlanır.
Civa veya sodyum buharları bulunan bir ortamdan çok renkli
(polikromatik) ultraviyole veya görünür ışın geçirildiğinde birkaç frekanstaki
enerjinin absorblandığı gözlenir ve basit bir spektrum elde edilir.
Şekil-4: Sodyumun
absorpsiyon spektrumu ve elektron geçişleri
Spektrumun basitliği, taneciklerin az sayıda enerji halinin
bulunmasından dolayıdır. Uyarılma, atomun bir veya daha fazla elektronunun daha
yüksek bir enerji seviyesine çıkarılmasıyla gerçekleşir. Bu elektronik bir
işlemdir. Na atomu için 3s elektronunun 3p haline geçirilmesi, yani uyarılması
için dalga sayısı 1.697 x 10-4 cm-1 (= 589.3 nm) olan
enerjiye gerekir. Bu nedenle sodyum buharının 589,3 nm’de (sarı ışık) keskin
bir absorbsiyon bandı bulunur; ayrıca diğer elektronik geçişler nedeniyle
oluşan birkaç dar absorbsiyon bandı da gözlenir.
Ultraviyole ve görünür ışının enerjisi, sadece en dıştaki
veya bağ yapan elektronların geçişini sağlayabilecek kadardır. X-ışınları ise,
atom çekirdeklerine çok yakın olan elektronları bile etkileyecek büyüklükte
enerjileri içeren frekanslardan oluşur. Bu nedenle en içteki elektronların
geçişlerini gösteren absorbsiyon pikleri X-ışınları bölgesinde gözlenir.
Moleküler Absorbsiyon
·
M + hn ¾® M*
(absorbsiyon 10-8 saniye)
·
M* ¾® M + ısı (relaksasyon prosesi)
·
M* ¾® A + B + C (fotokimyasal bozunma)
·
M* ¾® M + hn (emisyon)
Bir molekülün birkaç elektronik ve titreşim halini
tanımlayan enerji seviyeleri aşağıdaki şekil-5’de gösterilmiştir. Kalın
çizgilerden E0 molekülün temel halindeki elektronik enerjiyi (en
düşük), E1 ve E2 ise uyarılmış iki elektronik halini
gösterirler. Elektronik hallerin her birindeki titreşim enerji seviyeleri e0,
e1,.., en gibi harflerle tanımlanmıştır.
Temel hal ve elektronik olarak uyarılmış bir hal arasındaki
enerji farkı, bir elektronik halde bulunan titreşim seviyeleri arasındaki
enerji farklarına kıyasla çok büyüktür. Örneğin iki titreşim seviyesi
arasındaki enerji farkı 10 faktörü ile gösterilirse, iki elektronik hal arasındaki
enerji farkının faktörü 100 gibi bir sayıdır.
Işının absorbsiyonu sonucunda oluşan geçişler şekilde
oklarla gösterilmiştir. Görünür ışın, bir elektronu E0 seviyesinden
E1 seviyesinde bulunan herhangi bir titreşim seviyesine çıkarır. Bu
uyarılma nedeniyle absorblanan frekanslar,
Absorblanan ultraviole ışının frekansları da, aşağıdaki
denklemle bulunur.
Düşük enerjili yakın ve orta infrared ışın ise sadece temel
haldeki (E0) titreşim seviyeleri arasındaki geçişleri sağlayabilir.
Absorblanan enerjinin fraksiyonları aşağıdaki denklemle verilir.
Her bir titreşim seviyesi için bir kaç dönme enerji seviyesi
bulunur. Dönme seviyeleri arasındaki enerji farkı, titreşim seviyeleri
arasındaki enerji farkına kıyasla küçüktür. Uyarılmış dönme hallerine geçiş 500
cm-1 ile 100 cm-1 dalga sayıları aralığını kapsayan
enerjilerde gerçekleşir.
Keskin ve iyi tanımlanabilen hatların elde edildiği atomik
absorbsiyon spektrumunun aksine, ultraviyole ve görünür bölgelerdeki moleküler
spektrum geniş bir dalga boyu aralığını kapsayan absorbsiyon bantları ile
tanımlanır. Moleküler absorbsiyonda elektronik geçişler de söz konusudur.
Şekil-6:
Benzen buharı spektrumu
Bu nedenle, bir elektronik halde sayısız titreşim halleri
bulunduğundan her bir elektronik geçiş için birbirine yakın dalga boylarında
birkaç absorbsiyon bandı vardır. Ayrıca bir titreşim seviyesi için de çok
sayıda dönme enerji seviyesi bulunur. Bütün bunların sonucunda bir molekülün
spektrumu, birbirinin yakınında yer alan bir seri absorbsiyon bantlarından
oluşur. Örneğin, Şekil-6’daki benzen buharı spektrumunda bu durum gözlenmektedir.
Ayırma gücü yüksek enstrümanlar kullanılmadıkça her bir bant
ayrı olarak elde edilemez ve spektrum bir eğri halini alır. Katı halde bir
çözgen bulunması durumunda absorbsiyon bantları genişler.
Sadece titreşimin neden olduğu absorbsiyonlar IR bölgede
elde edilirler. Bu bölgedeki ışının enerjisi elektronik geçişi sağlayacak
büyüklükte değildir. Burada çeşitli titreşim kuvantum seviyeleri arasındaki
geçişler sonucunda dar ve birbirine yakın absorbsiyon bantlarının bulunduğu
spektrumlar alınır. Dönme seviyelerindeki değişiklikler, her bir titreşim
halinin pik sayısını artırabilir. Ancak sıvı ve katı maddelerde dönme olayı
çoğunlukla engellendiğinden bu tür örnekler için söz konusu küçük enerji farklılıkları
genellikle görülmez.
Gazların saf dönme spektrumları mikrodalga bölgesinde
oluşur.
Magnetik Alan
Tesiriyle Absorbsiyon
Bazı elementlerin elektronları veya çekirdeği kuvvetli bir
magnetik alan etkisinde bırakıldığında bu elementlerde, taneciklerin magnetik
özellikleri nedeniyle, yeni enerji seviyeleri oluşur. "Tesirle"
oluşan haller arasındaki enerji farkı küçüktür ve geçişler ancak uzun dalga
boylarındaki (veya düşük frekanslardaki) ışının absorblanmasıyla mümkündür.
Çekirdek için 10-200 MHz radyo dalgaları, elektronlar için ise 1000-25000 MHz
mikrodalgalar absorblanır.
Magnetik alandaki çekirdek veya elektronların ışın
absorblaması, moleküler yapının aydınlatılmasında uygulanan "nükleer
magnetik resonans (NMR)" ve "elektron spin resonans (ESR)"
tekniklerinin bulunmasını ve geliştirilmesini sağlamıştır.
Rezonans absorbsiyonda, gelen fotonun enerjisi atomu ilk
uyarılmış haline geçirir, kısa bir süre sonra tekrar gelen fotonun enerjisine
eşit enerjide bir foton çıkararak temel hale döner.
IŞININ EMİSYONU
Elektromagnetik ışın, genellikle, uyarılmış taneciklerin
(iyonlar, atomlar, veya moleküller) en düşük enerji seviyesine veya temel hale
geri dönmeleriyle elde edilir. Uyarma, çeşitli yöntemlerle yapılabilir;
elektronlar veya diğer elementer taneciklerle bombardıman, yüksek potansiyelli
değişken akım uygulaması, bir ark veya alevden ısı verme, veya elektromagnetik
ışın absorbsiyonu yöntemlerden bazılarıdır.
Birbirinden kolaylıkla ayrılabilen ışıyan tanecikler, gaz
halindeyken, bağımsız birer birim gibi davranırlar ve az sayıda ve özel dalga
boylarında ışın verirler. Sonuçta elde edilen spektrum "süreksiz" dir
ve "hat spektrumu" olarak tanımlanır. "Sürekli" spektrum
ise belirlenen bir dalga boyu aralığında tüm dalga boylarının bulunduğu veya
her bir dalga boyunun birbirinden ayrılmasının mümkün olmaması sonucu yanyana
yer aldığı bir spektrumdur.
Sürekli spektrum,
·
katılar ve sıvılar gibi atomların birbirlerine
çok yakın bulundukları ve bağımsız hareket edemedikleri maddelerin uyarılmasıyla,
veya
·
enerji halleri birbirine çok yakın olan karmaşık
moleküllerin uyarılmasıyla elde edilirler. Sürekli spektrum, ayrıca, kinetik
enerjileri belirli miktarda (kuvanta) olmayan taneciklerin enerji
değişikliklerinde ortaya çıkar.
Gerek sürekli spektrumun ve gerekse hat spektrumunun
analitik kimyada önemli bir yeri vardır. Sürekli spektrum spektrofotometre gibi
ışının madde ile etkileşimine dayanan yöntemlerde çok sık kullanılır. Hat
spektrumundan ise emitlenen taneciklerinin tayin ve teşhisinde yararlanılır.
Relaksasyon (Gevşeme)
İşlemleri
Işın absorbsiyonu sonucu uyarılmış hale geçen bir atom veya
molekülün bu halde bulunma süresi oldukça kısadır. Çünkü uyarılmış taneciklerin
temel hale dönmesine neden olan bazı relaksasyon olayları vardır.
Relaksasyon işlemi iki tiptir:
·
Işımasız Relaksasyon
·
Işımalı Relaksasyon
Işımasız Relaksasyon:
Işımasız relaksasyon, bir seri küçük basamaklarda meydana gelen enerji
kaybı ile ilgilidir; uyarma enerjisi, taneciğin diğer moleküllerle çarpışması
ile kinetik enerji şekline dönüşür. Bunun sonucunda sistemin sıcaklığında bir
miktar artış gözlenir.
Işımalı Relaksasyon: Relaksasyon,
fluoresans ışın çıkışı ile de meydana gelebilir.
Fluoresans ve
Fosforesans
Fluoresans ve fosforesans, atom ve moleküllerin bir
elektromagnetik ışın demetini absorblaması ve uyarılan taneciklerin tekrar
temel hale dönerken ışın vermesi esasına dayanan, analitik olarak önemli
emisyon olaylarıdır. Fluoresans, fosforesansdan çok daha hızlı oluşur ve
uyarılma anından sonra 10-5 saniye veya daha kısa bir süre içinde
tamamlanır; olay uyarıcı ışın demetine göre 90 derecelik bir açıdan kolaylıkla
izlenebilir. Fosforesans emisyonu, ışın absorbsiyonundan sonra 10-5
saniyeden büyük periyotlarda başlar, dakikalarca hatta saatlerce devam edebilir.
Absorblanan ve yayımlanan ışınların frekansları birbirinin
aynı ise olay "rezonans fluoresansı" olarak tanımlanır (Şekil-7’de
sağ taraftaki 1 ve 2 hatları). Burada tanecikler önce ışın absorblayarak E1
ve E2 enerji seviyelerine çıkarılmışlardır; bunlar, uyarma
bölgesindeki 1 ve 2 (E1- E0 ve E2 – E0)
hatlarıyla gösterilmiştir. Kısa bir periyod sonunda, aynı enerjiyi içeren ışının
emisyonu gerçekleşmiştir.
Rezonans fluoresansı, titreşim enerji seviyelerinin
bulunmadığı gaz halindeki atomlardan üretilir.
Rezonansız fluoresans, çözelti veya gaz halindeki
moleküllere ışın verilerek elde edilir. Işının absorbsiyonu ile moleküller iki
uyarılmış elektronik haldeki titreşim seviyelerine çıkarlar. Uyarılmış titreşim
hallerinin yaşam süresi çok kısa (~-5 s) olduğundan, diğer moleküllerle
çarpışarak enerjilerinin bir kısmını kaybederler ve bulundukları elektronik
haldeki en düşük enerjili titreşim seviyelerine geçerler.
Şekil-7: Fluoresans bir organik
molekül için enerji seviyeleri diyagramı
Moleküllerin bu son haldeki enerjileri, absorbladıkları
enerjiden daha küçüktür. Çıkan fluoresans ışının enerjisi rezonans halindekiyle
aynıdır, yani( E2 – E0) a eşittir.
Gerek resosans ve gerekse resonanssız ışınlar moleküllerin
fluoresans özelliklerinden doğar. Çok sayıda titreşim enerji seviyesi bulunması
nedeni ile rezonanssız fluoresans ışıma daha baskındır.
Fosforesans olayı uyarılmış bir molekülün, ortalama yaşam
süresi 10-5 saniyeden daha büyük olan bir yarı kararlı uyarılmış
elektronik hale geçmesiyle gerçekleşir.
Isıl (Termal) Işın
Katılar akkor hale kadar ısıtıldıklarında sürekli bir ışın
çıkışı olur. Çıkan ışın, çıkışına neden olan madde yüzeyinin bileşiminden çok
sıcaklığına göre karakteristik bir durum gösterir. Bu tip ışına
"siyah-cisim ışını" denir ve ısıl enerji ile katı içinde sayısız
atomik ve moleküler salınımlar oluşturularak elde edilir. Siyah-cisim ışının
teorik incelemesi aşağıdaki sonuçları verir:
·
Işındaki dalga boylarından mutlak sıcaklığın
tersi ile orantılı olan dalga boyu, maksimum değere sahiptir (lmaks. µ1/T);
·
Bir siyah-cisimden çıkan toplam enerji (birim
zaman ve alan için), sıcaklığın dördüncü kuvvetiyle değişir (Etoplam
µ
T4);
·
Belirli bir sıcaklıktaki ışının çıkış gücü dalga
boyunun beşinci kuvvetinin tersi ile değişir (P µ 1/l5).
Bazı ışın kaynaklarının davranışları Şekil-8’de
görülmektedir; bu kaynakların emisyonları ideal siyah cisme oldukça yakındır.
Enerji pikleri, artan sıcaklıklarda daha kısa dalga boylarına doğru kaymaktadır.
Ultraviyole ışın elde edilebilmesi için çok yüksek sıcaklıklarda uyarılan bir
kaynağa gereksinim vardır. İnfrared, görünür ve yakın dalga boyu ultraviyole
ışınlı analitik enstrümanlarda, ısıtılan katı kaynaklar kullanılır.
Şekil-8: Siyah
cisim ışın eğrileri
Gazların Emisyonu
Gaz halindeki atomlar, iyonlar ve moleküller elektrik
deşarjı veya ısı ile uyarılarak ultraviyole ve görünür bölgelerde ışın
verirler. İşlem, bir taneciğin en dıştaki elektronlarının uyarılmış elektronik
hale taşınmasıdır; uyarılmış elektronların tekrar temel hale dönmeleri
sırasında ışın emisyonu olur.
Atomik emisyon spektrumu, enerjileri çeşitli elektronik
haller arasındaki enerji farklarına eşit olan tek tek hatların oluşturduğu bir
spektrumdur. Moleküllerin emisyon spektrumu, her bir elektronik seviye için
birkaç titreşim ve dönme enerji seviyelerinin de bulunması nedeniyle çok
karmaşıktır; her elektronik geçiş için tek bir hat yerine birbirine oldukça
yakın uzaklıklarda yer alan çok sayıda hatların oluşturduğu bir emisyon bandı
görülür.
Gaz moleküllerin uyarılmasıyla bazen gerçek bir sürekli
spektrum elde edilebilir. Örneğin, hidrojen gazına düşük basınçta bir elektrik
deşarjı işlemi uygulanırsa hidrojen molekülü uyarılarak iki hidrojen atomu ve
bir ultraviyole foton verir. Bu işlemin enerjisi aşağıdaki denklemle verilir.
EH2 = eH1+
eH2 + hn
EH2 hidrojen atomunun uyarılma enerjisi
(kuvantize), eH1 ve eH2 atomların kinetik enerjileri, hn çıkan ışının enerjisidir. EH1 +
eH2 toplamı, sıfırdan EH2 değerine kadar değişir. Bu
nedenle, hn ışının frekansı da bu
aralık boyunca değişik değerler gösterir.
Şekil-9: (a)
Hidrojen atomunun spektral hatları, (b) bidrojen absorpsiyon ve emisyon
spektrumları; Balmer serisi
X - Işınlarının
Emisyonu
X-ışınları bölgesindeki ışın, normal olarak bir metal
hedefin yüksek hızdaki bir elektron bulutu ile bombardıman edilmesi ile
çıkarılır. Elektron demeti, hedef metaldeki atomların en içteki elektronlarını
ya daha yüksek enerji seviyelerine yükseltir veya tamamıyla atar. Uyarılan
atomlar veya iyonlar, daha sonra kademeli elektronik geçişlerle temel hal
seviyesine dönerler. Dönüş sırasındaki elektronik geçişlerde, her birinin
enerjisi hn (kuvanta) olan fotonlar
yayarlar.
Böylece elde edilen X-ışını spektrumunda, hedef maddeyi
karakterize eden bir seri hatlar bulunur. Bu spektrum, yüksek-hızlı
elektronların hedef maddeden geçerken çıkardığı bir kısım kuvanta dışı enerjili
ışının verdiği sürekli spektrumun üstünde çıkar.
X-ışını saçılması ve emisyonu temel prosesleri ile bir
molibden hedeften 35 kV da elde edilen X-ışınlarının spektrumu Şekil-10’da
görülmektedir. n = 2 seviyesinden n = 1 seviyesine geçen X-ışınlarına Ka, n = 3 seviyesinden n = 1 seviyesine
geçenlere de Kb X-ışınları
denilmektedir. İki keskin pikin sol tarafında bulunan geniş sürekli eğri
"bremsstrahlung" ışımasıdır.
Şekil-10: X-ışını
saçılması ve emisyonu temel prosesleri