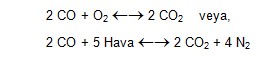YANMA KONTROLÜNDE CO – O2 – CO2 İLİŞKİSİ
Yanma
gazlarında bulunan oksijen (O2) miktarı, yanma işleminde kullanılan
fazla havanın bir ölçüsü olarak kabul edilmektedir. Yanma gazları zirkonyum
oksit proplu bir analizöre gönderilerek oksijen, bundan yararlanılarak da fazla
hava miktarı hesaplanır.
Yakın
zamanda yanma gazlarındaki oksijen yerine karbon monoksit (CO) miktarı üzerinde
durulmaya başlandı. Analiz yöntemi olarak da infrared absorbsiyon analizörleri
seçildi. Böylece çıkış gazlarındaki SO2, CO2, azot
oksitleri, v.s. gibi tüm gazların saptanması mümkün olabildi.
Yanma
veriminin arttırılmasına yönelik olarak gerek CO ve gerekse O2
analizine dayanan çok sayıda yazı yazılmıştır. Burada, yanma prosesi kimyasal
ve pratik yönlerden incelenerek, O2 ve CO analizörlerinin yanma
kontrolündeki fonksiyonlarının açıklanmasına çalışılacaktır.
Yanma Kimyası
Yanma, bir
yakıtın hava ile oksitlenmesi sonucu ısının açığa çıktığı kimyasal bir
işlemdir. Yakıtın bileşiminde esas olarak karbon (C) ve hidrojen (H2)
bulunur.
Karbonun
yanması, iki kademede tamamlanır. İlk kademede karbon monoksit (CO), ikinci
kademede ise karbon dioksit (CO2) oluşur. Yanma olayı, O2
veya hava ile yapılabilir.
O2
ile yanma,
2C + O2 ¨ 2CO
2CO + O2 ¨ 2CO2,
veya,
C + O2¨ CO2
Hava ile
yanma,
C + 5 Hava ¨ CO2 + 4N2
Reaksiyonlar,
özel koşullarda tersinirdir.
1 lb C un
CO2 vermek üzere yandığı zaman 14 100 Btu açığa çıktığı bilindiğine
göre, C u gaz olarak düşündüğümüzde, 1 ft3 CO in CO2 e dönüşmesinde
ise 340 Btu enerji elde edilir. Bu durumda 1 ft3 C un CO e dönüşmek
üzere yanması sonucu ancak 130 Btu açığa çıktığı görülür.
Bu basit
örnek, C un tam yanmaması halinde gerçek enerjinin ancak üçte birinden
faydalanılabileceğini göstermektedir. Hidrojenin yanması,
2H2 + O2 ¨
2H2O
veya,
2H2 + 5 Hava ¨
2H2O + 4N2
şeklindedir.
Her iki denklemde de tam yanma olayı gösterilmiştir. 1 ft3
hidrojenin yanma enerjisi 290 Btu dur. Reaksiyon, C un yanmasında olduğu gibi
tersinirdir.
Gaz Hesapları
Genel gaz
denklemi yukarıdaki eşitlikle verilir. Basınç (p) psia olarak ölçülürse hacim
(V) ft3, mutlak sıcaklık (T) Reomür cinsindendir. R = 10,73
sabittir. W/M, gazın ağırlığının molekül ağırlığına bölümüdür ve birimi
pound-moldür.
Bileşimlerin
molekül ağırlığı, bileşimi oluşturan elementlerin molekül ağırlıklarının
toplanmasıyla elde edilir. Şöyle ki; C = 12, H2 = 2, O2 =
32, N2 = 28, S = 32 olduğuna göre, yanma ürünlerinin molekül
ağırlıkları,
Ağırlıklar
pound olarak ifade edildiğinde, 12 pound C, 28 pound N2, 44 pound CO2
ve 16 pound metanın her biri 1 pound-mol dür.
Herhangi
bir gazın 1 pound-mol ünün 32 0F (0 0C) derecede ve 760
mm. Hg basıncındaki hacmi sabit olup 359 ft3 tür.
14.7 x V = 10.73 x (32 + 459) V
= 359 ft3
V nin
değeri, doğal olarak sıcaklık ve basınçla değişir. Karışımdaki gaz maddelerin
oranı ise T ve P ye bağımlı değildir. Bu nedenle gaz hesaplamalarında temel
referans p ve T değerlerini kullanmak yanlış olmaz.
Yakıt-Hava Hesapları
Burada,
tamamıyla yanabilen ve tamamıyla yanabilen fakat bir miktar inert gaz içeren
iki örnek gaza ait yakıt-hava hesaplamaları verilecektir.
1.
Tamamıyla Yanabilen Gaz
Örnek olarak metan gazının yanma olayını izleyelim:
Yakma
işlemi, hacimce %10 hava fazlasının bulunduğu ortamda yapılırsa, ilave %10 hava
(0.2 O2 + 0.8 N2) olduğundan çıkış gazındaki oksijen, %
1.7 bulunur.
"Fazla
hava" yanma ürünlerine (yani baca gazına) göre değil, yakılan yakıta göre
ifade edilen bir kavramdır. Uygulamada çıkış gazındaki O2 tayini,
havanın giriş sıcaklığından çok yüksek sıcaklıkta yapılır. Ancak % hacim hesabı
yapıldığından sıcaklık ve basınç farkı, sonucu önemli derecede etkilemez. Bir
gaz yakıtta kullanılan fazla hava miktarı, çıkış gazında bulunan % O2
miktarını, 5-6 gibi bir faktörle çarparak yaklaşık olarak hesaplanabilir.
Burada, gaz yakıtın inert ve O2 içermemesi esastır.
Metan
gazının yanması sonucu %1.7 O2 bulunduğundan,
fazla hava = 1.7 x 5 - 1.7 x 6 = % 8.5 - 10.2
arasındadır
Gerçekte ise %10 fazla hava kullanılarak yakma işlemi gerçekleştirilmişti.
Şekil-1(a) da yakıt gazındaki oksijenin fazla hava ile olan ilişkisi görülmektedir.
2.
Yanabilen Gaz ve İnert Gaz Karışımı
Gaz yakıt,
yanabilen ve inert (yanamayan) gazlar karışımı olabilir. Örneğin CO yanabilen,
CO2 ise yanamayan bir gazdır. Hacimce (% 30 CO + % 70 CO2
ve (% 10 CO + % 90 CO2) bulunan iki ayrı bileşimdeki gaz yakıtın %10
fazla havayla yakılmasını inceleyelim. CO in temel yanma denklemi,
(a) %30 CO + %70 CO2 gaz
karışımında, 2 hacim CO için 4.7 hacim CO2 vardır. Buna göre karışım
gazın yanma denklemi aşağıdaki gibidir
(b) % 10 CO + % 90 CO2 gaz
karışımında, 2 hacim CO için 18 hacim CO2 vardır. Karışımın normal
hava ile yanma denklemleri ve çıkış gazındaki O2 miktarı aşağıdaki
gibidir.
20 + 0.1 + 4.4
20 + 0.1 + 4.4
Buradaki
örneklerde, baca gazındaki O2 miktarları %0.9 ve %0.4 dür. Oysa her
iki yakıt da % 10 hava fazlasında yakılmıştır. Yakıtta bulunan yanabilen gaz
miktarının azalması, aynı miktarda fazla hava kullanılmasına rağmen baca
gazında daha az % oksijen bulunmasına neden olur. Açıkça görülmektedir ki yanma
gazlarında saptanan O2 miktarı, fazla havanın bir ölçüsü olamaz.
Veya %30 CO içeren yakıtın %10 fazla hava ile yanması sonucunda baca gazında
%0.9 O2 saptandığı için, %10 CO li bir yakıtın aynı koşullarda
yanmasında da çıkış gazında aynı miktar oksijen bulunmasını beklemek yanlıştır.
CO + CO2
karışımı yakıtta, CO miktarının %10 a düşmesi durumunda, çıkış gazında % 0.9 O2
bulunması istenirse, yakıtın yakılmasında kullanılacak fazla hava miktarının ne
kadar olması gerektiğini hesaplayabiliriz. Normal hava ile yanma denklemini,
fazla havayı A ile göstererek yazalım, (1 hacim hava 0.2 hacim O2,
0.8 hacim N2 dur):
Yanma
gazında % 0.9 O2 bulunabilmesi için, (% 30 CO + % 70 CO2)
karışımı bir yakıt %10 fazla havaya, (% 10 + % 90 CO2) karışımı bir
yakıt ise % 22.6 fazla havaya ihtiyaç gösterir. Proseste, iyi bir yanma için
hesaplanan miktarın iki katının üstünde hava verilmesi gerekir.
Değişik
oranlarda CO içeren (CO + CO2) karışımı yakıtın, sabit, %10 fazla
hava ile yakılmasıyla çıkış gazındaki %O2 miktarı hesaplanarak
yakıttaki % CO e karşı grafiğe alındığında Şekil-1b deki eğri elde edilir.
İçinde
inert gaz bulunan diğer yakıtlar için de benzer eğriler çizilebilir. Pek çok
yakıtın bileşimi tam olarak bilinemeyeceğinden çıkış gazındaki CO2
miktarı yerine, yakma havasındaki % fazla havanın sabit tutulması tercih
edilmelidir.
Yakıt
içindeki yanabilen maddeler miktarının uygun ekipmanlarla saptanabilmesi
durumunda, çıkış gazındaki O2 ayar-noktasının otomatik olarak
ayarlanabilmesi de mümkün olmaktadır.
Şekil-1: (a) Çeşitli yakıtlar için
yakıt gazındaki oksijenin fazla hava ile ilişkisi, (b) % 10 fazla hava
olduğunda çıkış gazındaki % O2 in, karışımdaki % CO ile ilişkisini,
gösteren grafikler
Btu Hesapları
1 pound
karbonun yanması ile 14100 Btu ısı açığa çıkar. Karbonu gaz olarak düşünürsek,
1 pound-mol karbonun hacmi 359 ft3 tür; yani 1 pound karbon 359/12 =
30 ft3 tür. 1 ft3 karbon ise 14100/30 = 470 Btu enerjiye
sahiptir.
Çeşitli
gaz yakıtların yanma ısıları, C için 470, H2 içinde 290 Btu alınarak
kolaylıkla hesaplanabilir. Örneğin benzenin yanma ısısı: C6H6
= 6 x 470 + 6 x 290/2 = 3690 Btu bulunur. Bu şekilde hesaplanan Btu değerleri
yaklaşıktır. Bazı gazların 1 atm. ve 32 0F deki gerçek ve hesapla
bulunmuş olan Btu değerleri aşağıda verilmiştir.
Çıkış Gazındaki Yanabilen Maddeler
Verimli
bir yanma için uygun hava/yakıt oranının seçilmesi dışında etkin olan üç
faktör: (1) fırındaki yakıt ve havanın iyi bir şekilde karıştırılması, (2)
yakıt-hava karışımının yanabileceği sıcaklığa erişmesi, (3) yanma işleminin tam
olabilmesi için, yakma sıcaklığının yeterli zaman sürecinde devam
ettirilebilmesidir. Zaman, sıcaklık ve karıştırma olayı da önemli olan
faktörlerdir.
Genel
olarak mükemmel denilebilecek bir yakıt hava karışımı yoktur. Keza, mükemmel
yanmayı sağlayacak şekilde karışımın sıcaklığını yanma sıcaklığının üstünde
yeterli süre tutmak her zaman mümkün olamaz. Bu sebeplerden fırın çıkış
gazlarında çoğunlukla yanmamış maddeler bulunur. Yanmanın kontrol altında
sürdürülebilmesi, iyi bir yanma olayında üzerinde durulacak en önemli husustur.
Yanmadaki üç temel faktör olan zaman, sıcaklık ve karıştırmanın yanında, çıkış
gazlarındaki yanabilen madde miktarının minimum, yanma olayının da ekonomik
olması önemlidir. Yakma havasındaki fazla havayı bir miktar arttırmakla, çıkış
gazındaki yanabilen madde miktarını azaltmak mümkündür. Böyle bir yol
izlenirken, yanma sonucu açığa çıkan yanma ısısından ne şekilde yararlanıldığı
da dikkate alınarak, enerji kaybına neden olmayacak şekilde dengenin sağlanması
gerekir.
Gaz
yakıtın hava ile karıştırılması, fuel oilün hava veya buharla iyi bir şekilde
atomize edilmesine rağmen yanma olayı, damlacıkların sıvı yüzeylerinde gerçekleşir.
Keza, kömürün yanmasında da aynı şekilde pulverize edilen kömür taneciklerinin
katı yüzeyleri üzerinde yanma başlar. Kömür ve diğer katı yakıtların yakılması
oldukça zordur. İri taneler halindeki kömürün toplam yüzey alanı, pulverize
kömüre göre çok az olacağından yanması daha da zorlaşır. Baca gazındaki CO
miktarı, uygun yakma koşulları altında 100 - 500 ppm. seviyelerinde olabilmektedir.
Yanma
prosesi sırasında ve sonrasında, temel yanma reaksiyonlarından başka
reaksiyonlar da olur. Örneğin, indirgen bir ortamda doğal gazın yakılmasıyla tamamıyla
karbon olan lamba isi meydana gelir ve fırında karbonlaşmaya neden olur.
Çıkış
gazında bulunabilecek az miktardaki yanabilen maddeler gerçekte fazla önemli
değildir. Bunu bir örnekle açıklayalım: 100 000 lb/saatlık buhar jeneratörünün
doğal gaz yaktığını varsayalım; verim %100 kabul edilirse kazan yaklaşık olarak
1000 ft3/sa 1000 Btu luk gaz ister. Bu miktarda gazın yakılabilmesi
için de 1 000 000 ft3/sa havaya ihtiyaç vardır. Yakma işlemi %10
hava fazlası ile yapıldığında gerekli hava 1 100 000 ft3/sa dir. Bu
koşullarda baca gazındaki CO in 200 ppm. (%0.02) olduğunu kabul edelim. ve CO
in 500 ppm e yükselmesi halinde enerji kaybının % kaç olduğunu hesaplayalım.
CO in 200
ppm den 500 ppm e yükselmesiyle baca gazında 300 ppm lik (%0.03) bir CO artışı
olacaktır. Bu miktar CO, ft3/saat cinsinden hesaplarınsa,
112 200 Btu,
112.2 lb/saat buhar üretildiğine göre, çıkış gazında CO in 200 ppm den 500 ppm
e yükselmesi sadece,
Çıkış
gazındaki CO in 500 ppm den 200 ppm e düşürülmesi için %1 fazla hava
kullanılması düşünüldüğünde, bu miktar hava, 1 000 000 x 0.01 = 10 000 ft3/sa
olacaktır. 10 000 ft3/sa hava, ortam ısısı 70 0F dan,
baca gazı çıkış sıcaklığı olan 600 0F e ısıtılacağına göre, ne kadar
enerjiye ihtiyaç vardır. Havanın öz ısısı 0.25 Btu/1b.hava.0F
alındığında, 1 lb. havanın hacmi 359/28.8 = 12.5 ft3,
Bir yanma
işleminde, çıkış gazlarındaki CO veya yanabilen maddelerin kontrolüne göre
yapılacak toplam hava akışı ayarlaması oldukça riskli bir yöntemdir. Çıkış
gazındaki CO, çoğu zaman atomizasyonun iyi yapılamaması, yakıcıların kirlenmesi
ve fırındaki kaçaklar gibi nedenlerden kaynaklanır. CO in sadece yakma
havasının yetersizliğinden ileri geldiği varsayıldığında, otomatik olarak hava
miktarı arttırılırsa da ayar noktasının üstünde hala CO görülür. Böyle hallerde
hava fazlası verimin düşmesine neden olabilir.
İyi bir
verim elde edilmesi, baca gazındaki yanabilen madde miktarındaki büyük
değişikliklerin, küçük miktarlarda hava artışı yapılarak sağlanmasıyla elde
edilir. Bir fırın için genel kural, sistemin test şartları altında kontrol
edilmesi ve kullanılan yakıta göre optimum yakıt/hava oranının saptanmasıdır.
Test sonuçları, şu bilgileri kapsamalıdır: (1) buhar üretim kapasitesi, (2)
relatif hava akış miktarı, (3) çıkış gazındaki % O2 miktarı, (4)
çıkış gazındaki % yanabilen maddeler miktarı.
Çıkış
gazındaki CO, çoğu hallerde yanabilen maddeler olarak kabul edilebilir; tam
doğru ifade ise CO + H2 toplamıdır. Yukarıdaki bilgilerden başka
baca gazının sıcaklığı, yakıcının tipi ve yakıtın Btu değeri de bilinmelidir.
Bir buhar üretim fabrikasındaki mühendis, test şartlarının daima yaklaşık
değerler olduğunu bilir, günlük çalışmalarda karşılaşılan çeşitli zorluklara
rağmen buhar jeneratörünü test koşullarına en yakın değerlerde çalıştırabilmek
için gerekli tüm önlemleri alır.
Yakma Havası
Çoğu
zaman, havanın bileşiminin sabit olduğu kabul edilir; kuru havanın bileşimi,
aşağıdaki tabloda verildiği gibidir. Oysa havada, bulunduğu yere ve mevsime
göre bir miktar nem vardır. Ayrıca çok az miktarlarda neon, helyum, kripton,
ksenon ve ozon (O3) bulunur. Bunlara ilaveten havada yine az
miktarlarda hidrokarbonlar, hidrojen peroksit, kükürt bileşikleri, klorürler,
sülfürik asit ve toz vardır. Anlaşıldığı gibi hava heterojen bir karışımdır.
Havadaki toz miktarı, temiz deniz havasında 250 tanecik/cm3 iken,
tozlu bir ortamda 2 000 000 tanecik/cm3 seviyesindedir. Havada CO de
bulunur ve temiz dağ havasında sıfır olan bu gaz, şehir havasında 50 - 100 ppm,
endüstri bölgelerinde ise 200 - 400 ppm e kadar yükselir. Havada bulunan
hidrojen, en temiz havada bile 100 ppm seviyesindedir.
Hava
Sızıntıları
Genellikle,
fırındaki basınç atmosfer basıncına yakın değerdedir. Yakma gazları üniteye
girdiği zaman basınç düşmeye başlar ve çekici fana yakın kısımlarda 10 inç su
sütununa kadar düşebilir. Fırındaki basınç ile çıkış negatif basıncı arasındaki
farktan kaynaklanan hava sızıntısı, yakma sıcaklığının altında bulunan kazan
çıkışında meydana gelir. Hava sızıntısı ile beraber gelen baca gazında O2 bulunduğu halde, esas yanmanın meydana
geldiği fırında yeterli yanma havası olmayabilir. Bu durumda yakıt gazı hem O2
ve hem de CO içerir.
Baca
gazındaki CO in hava sızıntısına bağlı olmadığını söylemek doğru değildir.
Yakma havasında sabit olmayan miktarlarda CO bulunur. Sızan havada CO olmaması
halinde, baca gazındaki CO azalacak ve buna bağlı olarak kontrol sistemi yakma
havasının miktarını azaltacaktır. Benzer şekilde eğer sızıntı havada fazla
miktarda CO bulunuyorsa, sistem hava akışını arttıracak, fırına gereken
miktardan fazla yakma havası çekilmiş olacaktır.
Uygulamada
karşılaşılan sorunlar başlıca yakıcıların kirlenmesi ve uygun olmayan biçimde
yerleştirilmeleri, hava ısıtıcılarının delinmesi, yakıt püskürtücülerinin
tıkanması ve fırın bafıllarının arızalanmasından ileri gelmektedir.
Yüksek
sıcaklık zirkonyum oksit problar 2800 0F gibi sıcaklıklarda hem O2
ve hem de yanamayan maddeleri algılayabilmektedir. Bu tip analizörler halen
çelik, cam, aliminyum ergitme fırınlarında kullanılmakta olup, buhar üretiminde
henüz uygulamaya alınmamıştır. Normal zirkonyum oksit problar ise 1400-1500 0F
da çalışırlar ve kazan fırın kısmına en yakın yere monte edilirler.
Yanma
prosesinde, çıkış gazındaki O2 miktarını tayin eden zirkonyum oksit
problu analizörler son yıllarda yaygın olarak kullanılmaktadır. Ayrıca, eser
miktarda CO tayini yapan İnfrared analizörler de yanma kontrolünde kullanılmaya
başlanmıştır. Ancak her iki sistem de tek başına yanma prosesinde karşılaşılan
sorunları çözmekte yeterli olamamaktadır.
Zirkonyum
oksit – O2 analizörü ile infrared - CO analizörünün fonksiyonlarını
bir arada toplayan mikroprosesser kontrol sistemleri ile, flue gazdaki O2
ve CO miktarları tayin edilerek fırın havasının kontrol altında tutulması
mümkün olabilmektedir. Oksijen kontrolüne dayanan yüksek ve düşük ayar
noktalarıyla yakıt-hava oranı, CO 1000 ppm i geçmeyecek şekilde
ayarlanabilmektedir.
GERİ (proje çalışmaları)