Kulometre, analiti kantitatif olarak başka bir oksidasyon
durumuna geçirmek için gerekli elektriği (kulon olarak) ölçen bir grup analitik
yöntemleri içine alır. Ölçülen kulon ile analitin ağırlığı arasında bilinen
fiziksel sabitlerden çıkarılan bir orantı sabiti vardır; bu nedenle bir
kalibrasyona ve standartizasyon kademesine gerek olmaz. Kulometrik yöntemler
gravimetrik veya volumetrik işlemler kadar doğrudur; ayrıca daha hızlıdır ve
gravimetrik tayinlere göre daha kullanışlıdır.
1.
Elektrik Yük Miktarı Birimleri
Elektrik yük miktarının Coulomb (C) ve Faraday (F) ile
ölçülür. Coulomb, bir amperlik (sabit) akımın bir saniyede geçmesi sırasında
akan elektrik miktarıdır. Buna göre I amperlik sabit bir akımın t saniye süre
ile akması halinde Q Coulomb elektrik elde edilir.
Faraday bir elektrotda bir eşdeğer kimyasal değişiklik
oluşturan elektrik miktarıdır. Bir oksitlenme-indirgenme reaksiyonundaki
ekivalan, bir mol elektronların değişimi demek olduğundan, Faraday 6.02 x
10<M^>23 elektrona eşittir. Bir Faraday
aynı zamanda 96491 Coulom'dur.
ÖRNEK
Bir çözeltiden 15.2 dakika süre ile sabit 0.800 A'lik akım
geçiriliyor. Oluşan ürünlerin sadece bakır ve oksijen olduğu varsayılarak
Katotta biriken bakır ile anotta çıkan O2 ‘in gram olarak
miktarlarının hesaplanması.
Eşdeğer ağırlıklar iki yarı-reaksiyondan hesaplanır.
Elektrik miktarı = Q = I.t
(denklem 5)
Faradayın tanımına göre Katotda 7.56 x 10-3
eşdeğer gram bakır birikir; anotda ise ayni miktarda oksijen çıkar. Buna göre,
2.
Kulometrik Yöntemler
Kulometrik analizlerde iki genel teknik uygulanır.
Birincisinde, çalışan elektrotun potansiyeli, analitin kantitatif olarak
yükseltgenme veya indirgenmesi sırasında çözeltideki daha az reaktif
tanecikleri etkilemeyecek bir seviyede tutulur. Burada akım başlangıçta
yüksektir, fakat hızla düşer ve analitin çözeltiden ayrılmasıyla sıfıra iner
(Şekil-5). Gereken enerji bir kimyasal kulometre ile ölçülür. İkinci teknikte,
gösterge sinyalinin reaksiyonun tamamlandığını gösterdiği ana kadar sabit akım
uygulanır. Eşdeğerlik noktasına ulaşıldığında, akımın miktarından elektrik
miktarı hesaplanır. Bu ikinci tekniğe "kulometrik titrasyon" denir,
uygulama alanı, birinci yönteme kıyasla daha geniştir.
Tüm kulometrik yöntemlerde temel ilke, tayin edilen analit
taneciklerinin %100 akım verimiyle reaksiyona girmesidir. Bunun anlamı, her bir
Faraday elektriğin bir eşdeğer analitin kimyasal değişimini sağlamasıdır. Bu
tarif analite, elektrottaki elektron değişimi reaksiyonuna doğrudan katılma
zorunluluğu yüklemez. Nadiren de olsa analit tümüyle veya kısmen, elektrot
reaksiyonunun dışında ikinci bir reaksiyona girebilir. Örneğin, demir(2)'nin
platin bir elektrotta yükseltgenmesinde başlangıçta akımın tümü, aşağıdaki,
reaksiyonunu verir.
Demir(II) konsantrasyonu azaldıkça, konsantrasyon
polarizasyonu anot potansiyelinin artmasına yol açar ve bu artış suyun
bozunması reaksiyonuna kadar devam eder (bu reaksiyon, yukarıdaki reaksiyona
rakiptir).
Demir(II) nin yükseltgenmesi tamamlanıncaya dek akım teoride
istenilen seviyeye kadar yükselir. Bu hatadan kaçınmak için elektrolizin
başlangıcında ortama bir miktar (tartılmamış) seryum(III) iyonu konur. Bu iyon
sudan daha düşük bir anot potansiyelinde yükseltgenir.
Oluşan seryum(4) elektrot yüzeyinden hızla difüzlenir ve
sonra eşdeğer miktarda demir(2) iyonlarını yükseltger.
Bu örnekte,elektrot yüzeyinde doğrudan oksitlenen demir(II)
iyonları tüm analitin sadece küçük bir kısmıdır. Ancak işlemin tamamından
alınan net sonuç iyonlarının tümünün elektrokimyasal yükseltgenmesinin (büyük
kısmı dolaylı olarak) %100 akım verimiyle gerçekleşmiş olmasıdır.
Dolaylı elektrokimyasal yükseltgenme işlemine bir başka
örnek de klorür tayinidir. İşlemde anot gümüş elektrottur ve akım verildiğinde
elektrottan gümüş iyonları oluşur. Bu iyonlar çözeltinin içine difüzlenerek
ortamdaki klorür iyonlarını gümüş klorür halinde çöktürürler. Klorür iyonları
hücrede herhangi bir yükseltgenme veya indirgenme reaksiyonuna girmemesine
rağmen miktarına eşdeğer miktarda akım harcanarak, yani %100 akım verimi ile
tayin edilmiş olur.
3.
Sabit Elektrot Potansiyelinde Kulometrik Yöntemler
Değişken akımlı kulometrede, çalışan elektrotun potansiyeli
analitin kantitatif olarak reaksiyon verebileceği, fakat çözeltideki diğer
maddelerin reaksiyona katılmayacağı bir değerde tutulur. Bu tip işlemler
(elektrot potansiyelinin sabit veya akımın değişken olması) elektrogravimetrik
bir yöntemin tüm avantajlarına sahiptir ve tartılabilir bir ürün elde edilme
zorunluluğu da yoktur. Örneğin kulometrik yöntemle arsenik tayininde arsenöz
asit (H3ASO3) elektrolitik oksidasyon reaksiyonu ile
platin bir anotta arsenik aside (H3ASO4) yükseltgenir.
Benzer şekilde, demir(II) ‘nin demir(III)e dönüşümü de anot potansiyelinin
kontrol altında tutulmasıyla gerçekleştirilebilir.
Cihaz: Bir sabit elektrot potansiyelli
kulometrik analiz, Şekil-8'de görülen tipte bir cihaz ile yapılır; cihazda akım
zamanın fonksiyonu olarak ölçülür ve elektrik miktarını denklem(6)ya göre
hesaplayan bir integratör bulunur.
Önceleri, akım-zaman integratörü olarak çalışan hücreye seri
bağlı "kimyasal kulometreler" kullanılmıştır. Bu sistemlerde
elektriğin miktarı, elektroliz sırasında kulometrede oluşan kimyasal
değişikliğin volumetrik veya gravimetrik ölçmelerle saptanmasıyla tayin edilir.
Hidrojen/oksijen kulometresi bu tip bir sisteme örnek olarak verilebilir;
burada potasyum sülfat çözeltisi içine daldırılmış bir çift platin elektrot
bulunur. Elektrotlarda açığa çıkan oksijen ve hidrojen bir gaz büretinde
toplanır ve toplam hacimleri ölçülür.
Modern integratörler elektroniktir ve çoğu, akımı zamanın
fonksiyonu olarak grafikleyen kaydedici cihazın bir parçası durumundadır.
Uygulama: Kontrollü potansiyelde yapılan
kulometrik yöntemler çeşitli metal iyonları tayininde çok yaygındır. En çok
kullanılan Katot civadır ve bu elektrotta iki düzine kadar metal
çöktürülebilir. Yöntem nükleer enerji sahasında (uranyum ve plutonyum
tayininde) çok kullanılır.
Kontrollü potansiyelde yapılan kulometrik işlem organik
bileşiklerin elektrolitik tayinlerine (ve sentezlerine) de olanak verir.
Örneğin, Meites, potansiyeli kontrol altında tutulan bir civa Katotta
trikloroasetik asit ve pikrik asidin kantitatif olarak indirgendiğini
göstermişlerdir.
Bu bileşiklerin kulometrik analizleri binde birkaç
duyarlıkla yapılabilir.
Değişken akımlı kulometrik yöntemlerle gaz veya sıvı
akımındaki maddelerin konsantrasyonu otomatik ve sürekli olarak izlenebilir.
Önemli bir örnek az miktardaki oksijen konsantrasyonunun tayinidir. Cihazın
şematik diyagramı Şekil-9'da verilmiştir. Poröz gümüş Katot gelen gazı küçük
kabarcıklar şekline dönüştürür; oksijen gözeneklerde kantitatif olarak
indirgenir.
Anot ağır kadmiyum bir levhadır; aşağıdaki yarı-reaksiyon
meydana gelir.
Burada galvanik bir hücre oluşmuştur ve dışardan enerji
verilmesine gerek duyulmaz. Üretilen elektrik standart bir dirençten geçer ve
bir milivolt kaydedicide potansiyel kaydedilir. Oksijen konsantrasyonu
kaydedilen potansiyelle orantılıdır ve kaydedici kağıt oksijen konsantrasyonu
değişikliğini ayni anda gösterir. Cihaz %1 ile 1 ppm aralığındaki oksijen
konsantrasyonunu ölçmeye uygundur.
Şekil-9: Bir gaz akımındaki O2 konsantrasyonunu sürekli
olarak kaydeden bir cihaz
4.
Kulometrik Titrasyonlar
Kulometrik bir titrasyonda analiti titre edecek titrant,
elektrolitik olarak oluşturulur. Bazı analizlerde, aktif elektrot işlemi ile
sadece titrantın oluşturulması sağlanır; örneğin, klorür iyonlarını titre eden
gümüş iyonlarının gümüş bir Katottan elektrolitik olarak çıkması gibi. Diğer
titrasyonlarda analit jeneratör elektrotla doğrudan ilişkide de olabilir.
Demir(II)'nin kulometrik oksidasyonu buna örnektir; demir(II) nin bir kısmı
elektrokimyasal olarak oluşan seryum(IV) ile yükseltgenirken bir kısmı da
doğrudan elektrot reaksiyonu ile yükseltgenir. Hangi şekilde olursa olsun net
işlem analitteki tek bir kimyasal değişiklik bakımından %100 akım verimine
ulaşır.
Kulometrik titrasyonda akım istenilen seviyede olmalı ve
titrasyon boyunca sabit tutulmalıdır; elektroliz sonunda sonucun kulon sayısı
(dolaysıyla eşdeğer sayısı) olarak alınabilmesi için akımın amper, zamanın da
saniye cinsinden saptanması gerekir. İşlemin sabit akım altında yapılmasıyla,
istenmeyen taneciklerin jeneratör elektrotta oksitlenme veya indirgenmesine
engel olunur; çözeltideki analit biterken konsantrasyon polarizasyonu başlar.
Sabit akım uygulanıyorsa, bu durumda elektrot potansiyeli artmalıdır. Bu
potansiyel artışı analit ile reaksiyon verebilecek bir madde oluşturmazsa akım
verimi %100 ün altına iner. Kulometrik titrasyonda analitik reaksiyonun çok
küçük bir kısmı çalışan elektrot yüzeyinden uzakta bir yerde olur.
Kulometrik bir titrasyonda normal volumetrik titrasyonlarda
olduğu gibi, kimyasal eşdeğerliğe ulaşılan dönüm noktasının saptanması gerekir.
Volumetrik analizlerde kullanılan dönüm noktası belirleme yöntemlerin çoğu
burada da uygulanabilir; indikatörün renk değiştirmesi, potansiyometrik,
amperometrik, ve iletkenlik ölçümleri gibi.
Volumetrik ve kulometrik titrasyon, dönüm noktası tayininden
başka benzerlikler de gösterir. Her ikisinde de tayini yapılacak analitin
reaksiyon kapasitesi saptanır; bu kapasite birinde standart bir çözelti ile,
değerinde elektrik miktarı ile belirlenir. Keza, her iki yöntemde de ana
reaksiyonun hızlı, tam ve yan reaksiyonlardan bağımsız olması gerekir.
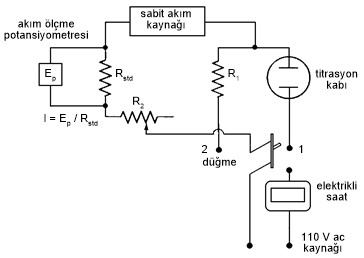
Kulometri
Cihazı: Tipik bir kulometrik
titratörün şeması Şekil-10'da verilmiştir. Sistemde bir sabit akım kaynağı ile
akımı başlatan ve elektrikli saati ayni anda çalıştıran bir açma kapama düğmesi
bulunur. Akımın doğru olarak ölçülmesi de çok önemlidir; bu işlem standart
dirençteki potansiyel düşmesi (R std ) ile yapılır.
Literatürde pek çok elektronik veya elektromekanik sabit
akım kaynağı tanımlanmıştır. Ucuz ve hazır amplifierler bu amaçla
kullanılabilen kolay sistemler olduğundan tercih edilirler.
Toplam elektroliz zamanın saptanmasında alelade bir
elektrikli saat kullanılması uygun olmaz. Bu tip saatlerin moturu,
durdurulduğunda ve çalıştırıldığında anında değil de biraz gecikmeyle devreye
girerler; sonuçda önemli derecede hataya neden olunur. Senoidle çalıştırılan
saatler veya elektronik zaman ölçerlerde böyle bir sorunla karşılaşılmaz.
Şekil-10'da görülen sistemin çeşitli kısımları ile normal
volumetrik analizlerde kullanılan çözeltiler arasındaki benzerlikleri
belirtmekte yarar vardır. Bilinen büyüklükteki sabit akım kaynağı, volumetrik
bir yöntemdeki standart çözelti ile ayni fonksiyondadır. Elektrik saati ve
açma- kapama düğmesi büret görevindedir; düğme büretin musluğu vazifesini
yapar. Kulometrik bir titrasyonun başlarında düğme uzun süre kapalıdır; dönüm
noktasına yaklaşılırken çok kısa zaman aralıkları ile açılıp kapanır. Büret ile
de benzer şekilde çalışılır.
Şekil-10: Kulometrik bir titrasyon
cihazının şematik diyagramı
Şekil-11: Tipik br kulometrik
titrasyon hücresi
Kulometrik Titrasyon Hücreleri: Tipik bir kulometrik titrasyon
hücresi Şekil-11'de görülmektedir. Hücrede, maddenin oluştuğu bir jeneratör
elektrot ile devreyi tamamlayan yardımcı bir elektrot bulunur. Jeneratör
elektrot yüzeyi oldukça büyük, dikdörtgen şerit veya tel bir sarım şeklinde bir
platindir (veya Şekil-6 'daki gibi bir kafestir).
İkinci elektrotta oluşan ürünler engelleyici maddelerden
ileri gelir. Örneğin anotda oksitlenen maddelerin oluşumu sırasında Katotta da
çoğunlukla hidrojen çıkar; bu gazın ortamdan uzaklaşmaması halinde oksitlenmiş
madde ile reaksiyona girme olasılığı vardır. Bu sıkıntılı durumu gidermek için
ikinci elektrot gözenekli bir disk ile çözeltiden ayrılır.
Yardımcı elektrotu çözeltiden ayırmak için uygulanan bir
başka yöntem de Şekil-12'deki gibi bir sistem kullanılarak maddeyi dışarıda
oluşturmaktır. Böyle bir sistemde akım kesildikten sonra kısa bir süre
elektrolit akışı devam eder, böylece kalan madde de titrasyon kabına alınır.
Şekil-12'deki cihaz, kullanılan kola bağlı olarak, hidrojen veya hidroksil
iyonu verebilir. Ayni sistem, iyodürün anotta yükseltgenmesiyle iyod vermesi
gibi, başka maddeler için de kullanılabilir.
5.
Kulometrik Titrasyon Uygulamaları
Kulometrik titrasyonlar her tür volumetrik reaksiyona
uygulanabilir. Aşağıda bazı örnekler verilmiştir.
Nötralizasyon
Titrasyonları: Zayıf ve
kuvvetli asitler, aşağıdaki reaksiyona göre oluşan hidroksit iyonlarıyla hassas
olarak tayin edilebilirler.
Burada Şekil-11 ve Şekil-12'deki hücreler kullanılabilir.
Ancak anot olarak gümüş tel kullanılır ve analitin bulunduğu çözeltiye klorür
veya bromür iyonları ilave edilir. Bu koşullar altında anot reaksiyonu
aşağıdaki şekilde olur.
Gümüş bromür, çoğunlukla anotta açığa çıkan hidrojen
iyonunda olduğu gibi nötralizasyon reaksiyonunu etkilemez.
Bu titrasyonlarda hem
potansiyometrik hem de indikatör dönüm noktası yöntemleri kullanılabilir.
Eşdeğerlik noktasının saptanmasında karşılaşılan sorunlar normal volumetrik
analizlerde olduğu gibidir. Kulometrik yöntemin asıl avantajlı tarafı karbonat
iyonlarınca yapılan engellemenin daha zayıf olmasıdır; karbon dioksidin
ortamdan uzaklaştırılmasının tek yolu, deneye başlamadan önce çözeltinin karbon
dioksit içermeyen bir gaz ile havalandırılmasıdır.
Kuvvetli ve zayıf bazların kulometrik titrasyonları, platin
bir anotta oluşturulan hidrojen iyonları ile yapılır.
Burada Katodun çözeltiden ayrılması veya reaksiyonun çözelti
dışında oluşturulması gerekir; aksi halde ayni elektrotta meydana gelen
hidroksil iyonu reaksiyonu engeller.
Çökelme
ve Kompleks Oluşumu Titrasyonları:
Anotta gümüş veya başka iyonlar oluşturarak çeşitli kulometrik titrasyonlar
yapılabilir (Tablo-3). Şekil-11'deki gibi bir hücreye ağır gümüş telden
yapılmış bir jeneratör elektrot takılır. Dönüm noktaları potansiyometrik veya
kimyasal indikatör yöntemiyle izlenir.
Anodun civa olması halinde civa iyonları oluşturularak da benzer analizler
yapılabilir.
Tablo-3: Nötralizasyon, Çökelme ve Kompleks Oluşumu Reaksiyonlarının
Kulometrik Titrasyon Uygulamaları
İlginç bir kulometrik titrasyonda etilendiamin-tetraasetik
asitin (H4Y) amin civa(2) kompleksi çözeltisi kullanılır. Kompleks
yapıcı madde, aşağıdaki reaksiyonla Katotta oluşur.
Civa şelatı, kalsiyum, çinko, kurşun veya bakır
komplekslerinden daha kararlı olduğundan elektrot reaksiyonu tamamlanıncaya kadar
bu iyonların kompleksleri oluşmaz.
Yükseltgenme
- İndirgenme Titrasyonları: ablo-4'de
kulometrik olarak oluşturulan çeşitli maddeler görülmektedir. Oksitleyici
maddeler arasında en çok uygulama alanı olan madde bromdur. +2 değerli gümüş
iyonu, +3 değerli manganez iyonu ve +1 değerli bakır klorür kompleksi de bu tür
maddelerdir, ancak bunların çözeltileri kararsız olduğundan tercih edilmezler.
Tablo-4: Yükseltgenme –İndirgenme Reaksiyonlarının
Kulometrik Titrasyon Uygulamaları
Kulometrik Titrasyon Uygulamaları
Madde
|
Oluşan elektrot reaksiyonu
|
Saptanan madde
|
Br2
|
2
Br- ¨ Br2 + 2e-
|
As(III),
Sb(III), U(IV), Ti+, I-, SCN-, NH3,
N2H4, NH2OH, fenol, anilin,
8-hidroksikinolin
|
Cl2
|
2
Cl- ¨ Cl2 + 2e-
|
As(III),
I-
|
I2
|
2
I- ¨ I2 + 2e-
|
As(III),
Sb(III), S2O3-2, H2S
|
Ce+4
|
Ce+3
¨ Ce+4
+ e-
|
Fe(III),
Ti(III), U(IV), As(III), I-, Fe (CN)6-4
|
Mn+3
|
Mn+2
¨ Mn+3
+ e-
|
H2C2O4,
Fe(II), As(III)
|
Ag+2
|
Ag+
¨ Ag+2
+ e-
|
Ce(III),
V(IV), H2C2O4, As(III)
|
Fe+2
|
Fe+3
+ e- ¨ Fe+2
|
Cr(IV),
Mn(VII), V(V), Ce(IV)
|
Ti+3
|
TiO+2
+ 2 H+ + e- ¨ Ti+3 + H2O
|
Fe(III),
V(V), Ce(IV), U(VI)
|
CuCl3-2
|
Cu+2
+ 3 Cl- + e- ¨ CuCl3-2
|
V(V),
Cr(VI), IO3-
|
U+4
|
UO2+2
+ 4 H+ + 2e- ¨ U+4 + H2O
|
Cr(VI),
Ce(IV)
|
Kulometrik
ve Volumetrik Titrasyonların Kıyaslaması: Klasik volumetrik titrasyonlarla kıyaslandığında, kulometrik
titrasyonların bazı avantajları olduğu görülür. Bunların en başta geleni
standart çözelti gereksinimin olmamasıdır. Bu avantaj özellikle klorür, bromür
veya titantum(3) iyonları standart çözeltilerin kararsız oluşları bakımından
çok önemlidir. Oysa bunların kulometrik analizlerde kullanılması oluşmalarından
hemen sonra analit ile reaksiyona girmeleri nedeniyle oldukça kolay ve
olumludur.
Çok az miktarda madde kullanılması gerektiği hallerde
kulometrik titrasyon çok avantajlıdır. Uygun bir akım seçilerek ortamda
mikroseviyelerde madde oluşması sağlanır; oysa normal volumetrik analizde çok
seyreltik çözeltiden az miktarda kullanılması gerekir ki bu da sağlıklı sonuç
alınmasını zorlaştırır.
Çökelme, yükseltgenme-indirgenme veya nötralizasyon yapıcı
maddelerin oluşturulmasında tek bir sabit akım kaynağından yararlanılır.
Otomatik titrasyonda akım kolay kontrol edilebildiğinden kulometrik yöntemlerle
çalışılabilir.
Kulometrik titrasyonlarda beş önemli hata kaynağı vardır:
(1) elektroliz sırasında akımdaki değişiklikler, (2) işlemin %100 akım
verimiyle gerçekleşmesinden sapma, (3) akım ölçümünden kaynaklanan hata, (4)
zaman ölçümünden kaynaklanan hata, (5) eşdeğerlik noktası ile dönüm noktası
arasındaki farktan ileri gelen hata. Bunlardan (5)deki konu volumetrik
yöntemlerde hemen her zaman karşılaşılan bir hata kaynağıdır; İndikatör
hatasının sınırlandırılmış olması halinde her iki yöntemin güvenirliği hemen
hemen aynıdır.
Sistemdeki akımın kararlılığı, basit cihazlarla relatif
olarak %0.2 seviyelerinde sabit tutulabilir; daha gelişmiş cihazlar
kullanılarak bu değer %0.01'e kadar düşürülebilir. Akım dalgalanmalarından
kaynaklanan hata çoğunlukla önemli değildir.
Elektrot prosesi ile ilgili belirsizliğin büyüklüğünü
genelleştirmek zordur, ancak literatürdeki kayıtlara göre akım verimleri %99.5
hatta %99.9 seviyelerindedir. Akımlar, ± %0.1 bağıl yakınlıkla ölçülebilir. İyi bir
zaman ölçer de zamanı ayni şekilde ± %0.1 bağıl
yakınlıkla ölçebilir.
Sonuç olarak özetlenirse bir kulometrik titrasyondaki
akım-zaman ölçümleri, özellikle çok az miktarlarda madde kullanılması gerektiği
hallerde, klasik volumetrik bir analizdeki hacim-normalite ölçümlerine kıyasla
çok daha doğru olur. Bir titrasyonun başarısı sadece bu ölçümlere değil daha
çok dönüm noktasının hassasiyetine bağlı olduğundan, her iki yöntemde alınan
sonuçların birbiriyle kıyaslanabilir seviyede olduğu söylenebilir.
6.
Otomatik Kulometrik Titratörler
Otomatik kulometrik titratör üreten pek çok firma vardır.
Bunlardan çoğunda potansiyometrik dönüm noktası tayin yöntemi kullanılır ve
otomatik titratörlere benzer şekilde dizayn edilmişlerdir. Bu tip cihazlarda
hata sinyali sıvı madde akışını (otomatik titratör) değil elektrik akımını
kontrol eder. Bazı cihazlar çok amaçlıdır ve çeşitli maddelerin tayininde
kullanılabilir. Bazıları ise tek bir analize yöneliktir; bu tip cihazlara örnek
olarak gümüş iyonlarının kulometrik olarak oluşturulduğu klorür titratörleri,
anotik olarak oluşturulan bromun analiti sülfat iyonlarına yükseltgendiği
kükürt dioksit monitörleri ve Karl Fisher maddesinin elektrolitik olarak hazırlandığı
su tayin titratörleri gösterilebilir.