Elektroanalitik çalışmalarda bir hücre potansiyelinin iki
yarı-hücre veya elektrot potansiyellerinden oluştuğu kabul edilir. Bunlardan
biri katot diğeri anotun elektrot potansiyelleridir.
EAgCl, hücrenin katotu olan gümüş/gümüş klorür
elektrotunun elektrot potansiyeli, EH2 de anot olan hidrojen gaz
elektrotunun elektrot potansiyelidir. Daniell hücresi için de (Şekil-1) benzer
yorumla,
yazılır. İfade genelleştirilirse,
denklemi elde edilir. Burada E katot katot olarak, E anot ‘da anot olarak hareket
eden elektrotların elektrot potansiyelleridir.
Öncelikle, tüm voltaj ölçme aletlerinin sadece potansiyeller
arasındaki farkı ölçmeleri nedeniyle tek bir elektrotun mutlak potansiyel
değerinin saptanmasının mümkün olmadığını belirtmek gerekir. Voltaj ölçme
aletinin bir ucu, yarı- hücredeki elektrot potansiyeli ölçülecek elektrota
bağlanır. İkinci uç aynı yarı-hücredeki çözeltiye daldırılır; burada kaçınılmaz
olarak katı-çözelti yüzeyler arası bir bölge oluşur ve yeni bir kimyasal
reaksiyonun bulunduğu (eğer elektrik akıyorsa) ikinci bir yarı-hücre doğar. Bu
ikinci reaksiyon nedeniyle bir potansiyel oluşur. Böylece aletle ölçülen değer
ölçülmek istenen yarı-hücre potansiyeli mutlak değeri değil bununla,
voltmetrenin ikinci ucunun çözeltiye daldırılmasıyla oluşan ikinci yarı-hücre
potansiyelinin toplamı, yani "bağıl (relatif) yarı-hücre"
potansiyelidir.
Mutlak potansiyellerin ölçülememesi, relatif yarı-hücre
potansiyel değerlerinin gerekli hesaplamalarda kullanılabilir olması nedeniyle
önemli bir sorun değildir. Bu değerlerden hücre potansiyelleri hesaplanabilir
ve ayrıca yükseltgenme - indirgenme reaksiyonlarının denge sabitleri bulunabilir.
Standart hidrojen elektrotu (SHE) bağıl yarı-hücre
potansiyelleri hakkında bilgi veren genel bir referanstır ve bir gaz
elektrottur; kolay monte edilebilir, reversibledir ve elde edilen sonuçlar
kararlıdır. Yarı-reaksiyon,
SHE potansiyelinin her sıcaklıkta 0.000 V olduğu kabul
edilir.
İlk elektrokimyasal çalışmalarda pH ölçmelerinde hidrojen
elektrotu hem referans hem de indikatör elektrot olarak kullanılmıştır.
Bileşimi aşağıdaki şekilde yazılır.
Pt, H2 (p
atm) l H+ (x M)
Parantez içindeki terimlerden anlaşıldığı gibi platin
yüzeyde oluşan potansiyel, çözeltideki hidrojen iyonu konsantrasyonuna ve
çözeltiyi doygun hale getirmek için kullanılan hidrojenin kısmi basıncına
bağlıdır.
Şekil-9: Hidrojen elektrodu
Şekil-9'da bir hidrojen elektrotunun kısımları
görülmektedir. İletken kısım, platin levhadan hazırlanmış ve çok ince platin tozlardan
oluşan bir tabaka ile kaplanmıştır. Kaplama işlemi kloroplatinik asitten (H2PtCl4)
elektrokimyasal indirgenme reaksiyonu ile platinin (platin siyahı) ayrılmasıyla
yapılır. Platin siyahının yüzey alanı çok büyüktür ve elektrot yüzeyinde çift
yönlü
reaksiyonun hızla cereyan etmesini sağlar. Hidrojen akımı ile elektrot çevresindeki çözelti gaz ile doygun halde tutulur.
Potansiyel Nernst eşitliğiyle verilir.
p(H2) hidrojen gazının kısmi basıncı, a(H+)
hidrojen iyonunun aktivitesidir. Bu reaksiyon için, her sıcaklıktaki E0
= 0.000 V’dur.
Hidrojen elektrotu, bulunduğu yarı-hücrenin özelliğine göre
anot veya katot gibi hareket edebilir. Hidrojen, anotta hidrojen iyonuna
yükseltgenir, katotta ise bunun tersi reaksiyon olur. Özel koşullar altında
hidrojen elektrotu elektrokimyasal olarak çift yönlü, yani dönüşümlüdür.
Bir hidrojen elektrotunun potansiyeli sıcaklık, çözeltideki
hidrojen iyonu konsantrasyonu (daha doğru olarak aktivite) ve elektrot
yüzeyindeki hidrojenin basıncına bağlıdır. Yarı- hücre reaksiyonunun referans
konumunda olması için bu parametrelerin çok dikkatli seçilmesi gerekir.
Standart hidrojen elektrotu şartnameleri, bu elektrotu:
hidrojen iyonu aktivitesi 1 ve hidrojen gazının kısmı basıncını 1 atm. olan;
veya, potansiyeli her sıcaklıkta tam olarak sıfır olan elektrot, şeklinde tarif
eder.
Bir elektrot ile standart hidrojen elektrotunun bulunduğu
bir hücrenin elektrot potansiyellerine "hücre potansiyelleri" denir.
Elektrot potansiyellerinin relatif değerler olduğu daima bilinmelidir.
Standart hidrojen elektrotu, genel bir referans standardı
olarak kabul edilmiş olmasına rağmen, laboratuvarda gerçekleştirme olanağı
yoktur; yani nazari bir elektrottur. Çünkü hidrojen iyonu aktivitesi tam 1 olan
bir çözelti hazırlamak mümkün değildir; ayrıca çözeltideki iyonik şiddeti 1
gibi büyük bir değerdeki hidrojen iyonunun aktivite katsayısını hesaplayacak
herhangi uygulanabilir bir teori de yoktur. Bu nedenle aktivitesi 1 olacak
gerekli HCl (veya başka bir asit) konsantrasyonunu hesaplamak olanaksızdır.
Aktivite katsayılarının bilindiği çok seyreltik çözeltiler için elde edilen
bilgilerden aktivitenin 1 olduğu haldeki potansiyeller bulunabilir. Örneğin,
Şekil-2'deki hücrede hidrojen ve klorür iyonlarının aktiviteleri Debye-Hückel
bağıntısından hesaplanabilir; ölçmeler düşük asit konsantrasyonlarında yapılmış
olmalıdır. Bu bilgiler kullanılarak ekstrapolasyon yöntemiyle, hidrojen ve
klorür iyonları aktivitelerinin 1 olduğu nazari bir hücrenin potansiyeli hakkında
bilgi edinilebilir. Şekil-2'deki hücre için (11) denklemi aşağıdaki duruma
indirgenir.
E0AgCl, aşağıdaki yarı-hücre
reaksiyonunun standard elektrot potansiyelidir.
Bir sıvı-bağlantısı veya tuz köprüsünün bulunduğu, hidrojen
ve klorür iyonlarının bağımsız olarak değişebildiği bir hücre düşünelim. Bu
hücre, örneğin,
hücresi olsun. Bu hücrenin sol yarım kısmı deneysel olarak
gerçekleştirilemez, fakat potansiyeli, aH+ ın 1'den epeyce küçük
olduğu bir hücre için saptanan verilerden hesaplanabilir. Temas potansiyelleri
ihmal edildiğinde bu hücrenin potansiyeli, veriler (11) denkleminde yerine konularak elde
edilebilir.
Bu eşitlik gümüş/gümüş klorür elektrotu elektrot
potansiyelinin (EAgCl), klorür iyonu konsantrasyonu ile nasıl
değiştiğini gösterir.
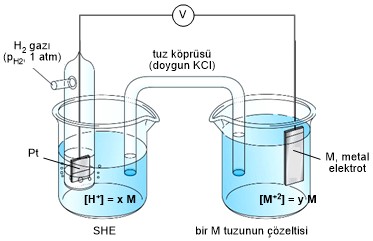
Şekil-10'da görüldüğü gibi tuz köprüsü bulunan bir hücre,
elektrot metali ve bu metalin iyonlarının reaksiyona girdiği yarı reaksiyonun
potansiyelini ölçmede kullanılabilir. Burada görülen referans elektrot bir
hidrojen elektrotu gibidir; asit konsantrasyonu, hidrojen iyonu aktivitesini
Debye-Hückel denkleminden hesaplayacak kadar düşüktür. Veya refarans elektrot
olarak 6. kısımda incelenecek olan ikincil elektrotlardan herhangi biride
kullanılabilinir; bunun standard hidrojen elektrota karşı olan potansiyeli
önceden bilinmektedir. Metal iyonu aktivitesi y değiştirilerek hücre
potansiyeli ölçülür. Uygun bir ekrapolasyon yapılır ve yarı-reaksiyonun E0M
potansiyeli hesaplanır.
E0M, M+2 ve H+
aktiviteleri 1 olduğu zaman hücrenin potansiyelini gösterir. Bu ölçme
sıvı-teması bulunmayan bir hücrenin potansiyeline kıyasla daha az doğrudur;
çünkü sıvı temasının her iki ucunda temas potansiyelleri vardır ve durum bir
dereceye kadar düzensizlik yaratır.
Şekil-10'daki metal (M) kadmiyum ise ve çözeltide 0.01 M Cd
iyonları bulunuyorsa ölçme aletindeki voltaj (V), 0.5V civarındadır. Cd anot
olarak görev yapar; elektronlar bu elektrottan dış devre yoluyla hidrojen
elektrotuna doğru geçerler. Bu galvanik hücrenin yarı - hücre reaksiyonları
aşağıdaki gibi yazılır.
Şekil-10: Standart
hidrojen elektroda karşı elektrot potansiyellerinin ölçülmesinde kullanılan bir
hücrenin şematik görünümü
Eğer kadmiyum elektrotu yerine 0.01 M çinko elektrotu
kullanılsaydı potansiyel 0.8V civarında olurdu. Bu hücrede de anot metal
elektrotudur. Oluşan daha yüksek potansiyel çinkonun yükseltgenme eğiliminin
daha fazla olmasından kaynaklanır. Bu potansiyel ile anodun kadmiyum olması
halinde saptanan potansiyel arasındaki fark bu iki metalin hangisinin daha
kuvvetli indirgeyici olduğunu gösterir. Örnekte 0.8-0.5 = 0.3V farkla çinko
metali kadmiyumdan daha kuvvetli indirgeyicidir, veya çinko daha kolay
yükseltgenebilen bir metaldir. Hidrojen elektrotuna karşı gözlenen kadmiyum
için 0.5V, çinko için 0.8V potansiyeller, bu metallerin indirgeme güçlerinin
kantitatif ölçüleridir.
Şekil-10'daki yarı-hücrede 0.01 M bakır (2) iyonlarına
daldırılmış bir bakır elektrot bulunması halinde 0.3V luk bir potansiyel
oluşur. Önceki iki örneğin tersine metalik bakır birikimi gözlenir; dış
elektron akımı hidrojen elektrottan bakır elektrota doğrudur. Hücre reaksiyonu,
kadmiyum ve çinko elektrot örneklerinde gözlenen reaksiyonların tersi bir
reaksiyondur.
Buna göre metalik bakır çinko, kadmiyum veya hidrojene göre
etkinliği daha az olan bir indirgeyicidir. Gözlenen potansiyel bu indirgeme
gücünün kantitatif bir ölçüsüdür.
Başka bazı ölçmeler ve uygun eksrapolasyonlar yapılarak, M+2
ve H+ aktivitelerinin 1 olması koşuluyla deneysel verilerden doğru
potansiyeller hesaplanır. Buna göre Cd+2 için 0.403, Zn+2
için 0.763 ve Cu+2 için 0.337 değerleri saptanır. Burada hidrojen
elektrotu ile birarada kullanıldığında bakır elektrotun katot, kadmiyum ve
çinko elektrotların ise anot durumunda bulunduklarını belirtmek gerekir.
Aradaki farkı tanımlamak için pozitif ve negatif işaretler kullanılır;
işaretlerin seçimi tamamıyla isteğe bağlıdır.
Örneğin, bakırın potansiyellerine (+) işaret kullanılırsa
(katot), kadmiyum ve çinko elektrotlarının potansiyeli (-) işaretiyle
gösterilir; veya bunun tersi olan işaretleme de uygulanabilir. Yine de seçilen
işaretlemenin değiştirilmeden hep aynı sisteme göre uygulanması gerekir.
Anodun hidrojen elektrodu, katodun gümüş elektrodu olduğu
bir hücrede gümüş elektrodunun elektrot potansiyelinin ölçülmesi örneğinde,
gümüş iyonu aktivitesi 1.00 ise, hücre potansiyeli Ag+/Ag yarı hücre
reaksiyonunun standart elektrot potansiyelidir; hücrede 0.799 V bir potansiyel oluştuğu görülür.
Hücre diyagramı:
Ag+/Ag elektrodunun standart elektrot potansiyeli
nedir?
Çözüm:
ÖRNEK. 8
Şekil-11:
Örnek-8 hücreler
Şekil-11(a): Anodun hidrojen elektrodu, katodun bakır
elektrodu olduğu bir hücrede 0.340 V bir potansiyel oluştuğu görülür; standart
elektrot potansiyeli E0Cu+2/Cu nedir?
Hücre diyagramı:
Şekil-11(b): Anodun hidrojen elektrodu, katodun çinko
elektrodu olduğu bir hücrede -0.763 V bir potansiyel oluştuğu görülür; standart
elektrot potansiyeli E0 Zn+2/Zn nedir?
Hücre diyagramı:
Çözüm:
Standart hücre potansiyeli, E0hücre:
iki standart elektrottan oluşan bir hücrenin potansiyel farkıdır.
(b)
Anodun kadmiyum elektrodu, katodun hidrojen elektrodu olduğu
bir hücrede -0.403 V potansiyel oluştuğu görülür, standart elektrot potansiyeli E0Cd+2/Cd
nedir?
Hücre diyagramı:
Standart hücre potansiyeli, E0hücre:
iki standart elektrottan oluşan bir hücrenin potansiyel farkıdır.
İşaretlemenin isteğe göre yapılabilmesi keyfiyeti
elektrokimyanın gelişiminde çeşitli tartışma ve karşıt görüşlere neden
olmuştur. 1953 yılında IUPAC organizasyonu bu kargaşayı temelinde çözmek
amacıyla sabit bir işaretleme sistemine karar vermiştir. Bu sisteme IUPAC veya
Stockholm kuralı denir.
Yarı-hücre reaksiyonu ister yükseltgenme ister indirgenme
reaksiyonu olsun tek bir yönteme göre yazılır. Bu yöntem yarım-hücre
reaksiyonunun indirgenme reaksiyonu olarak yazılmasıdır. IUPAC'a göre
"elektrot potansiyeli" (veya, olarak bağıl elektrot potansiyeli)
sadece indirgenme olarak yazılan yarı- hücre reaksiyonları için kullanılır.
Ters yönde yazılan bir elektrot reaksiyonu "yükseltgenme potansiyeli"
terimi ile tarif edilemez; ve yükseltgenme potansiyeline elektrot potansiyeli demek
de yanlış bir ifadedir. Bir yükseltgenme potansiyelinin işareti, karşılığı olan
indirgenme potansiyelinin daima tersidir.
Elektrot potansiyelinin işareti, incelenen elektrotun bir
galvanik hücrede standart hidrojen elektrotu ile birarada bulunması durumundaki
davranışına göre, göstereceği gerçek işareti ile saptanır. Bir çinko veya
kadmiyum elektrotu, elektronlar dış devreden hidrojen elektrotuna doğru
aktığından anot görevi yapar. Bu metaller böyle bir galvanik hücrenin negatif
ucudurlar ve elktrod potansiyelleri de bu nedenle negatif değerliklidir. Yani,
Diğer taraftan bakır elektrotunun potansiyeli, bu elektrot
ile standard hidrojen elektrotu çifti ile hazırlanan galvanik hücrede bakırın
katot davranışında olması nedeniyle pozitif işaretlidir; elektrotlar, dış
devreden bakıra doğru akarlar. Bakır elektrot galvanik hücrenin pozitif ucunu
oluşturur.
Elektrot potansiyelleri ve işaretlerinin, indirgenme reaksiyonu olarak yazılan yarı-hücre reaksiyonlarına uygulanabilmesi önemli bir husustur. Çinko ve kadmiyum, hidrojen iyonu ile yükseltgenirler; böylece olan reaksiyon bir yükseltgenme reaksiyonudur. Burada elektrot potansiyelinin işareti, indirgenmenin standart hidrojen elektrotuna karşı kendiliğinden olup olmadığını belirtir. Bakır elektrotunun pozitif işareti
reaksiyonunun, tabii koşullar altında sağ tarafa doğru
olduğunu belirtir. Diğer taraftan çinko için verilen negatif elektrot
potansiyeli yukarıdakine benzer,
reaksiyonunun tabii olarak sağ tarafa doğru olmadığını,
dengenin sol tarafa doğru yatkın olduğunu gösterir.
IUPAC kuralı 1953'de kabul edilmiştir; birçok kitap ve referans
çalışmalarında karşılaşılan veriler bu kurala uygun değildir. Örneğin Latimer
(1952) tarafından verilen yükseltgenme potansiyeli verilerinde çinko ve bakır
için,
bilgileri bulunur. Bu yükseltgenme potansiyellerini IUPAC
kuralına göre elektrot potansiyeline çevirmek için: (1) yarı-hücre reaksiyonu
indirgenme reaksiyonu olarak yazılır, (2) potansiyel değerlerinin işareti
değiştirilir.
Standart potansiyeller tablosunda kullanılan işaretleme
kuralı açık bir şekilde belirtilmemiş olabilir. Bu durum, kişinin bildiği bir
yarı- hücre reaksiyonunun yönü ve potansiyelin işareti ile açıklığa
kavuşturulabilir. Bundan sonra gerekiyorsa IUPAC kuralı uygulanabilir. Örneğin
herkesin oksijen gibi kuvvetli yükseltgeyici bir maddenin IUPAC kuralına göre
büyük bir pozitif elektrot potansiyeli olduğunu hatırlaması gerekir. Buradaki
reaksiyon ve elektrot potansiyeli aşağıdaki gibidir.
Reaksiyon, standard hidrojen elektrotuna karşı kendiliğinden
(sağ tarafa) olur. Bu reaksiyonun yönü ve işareti, herhangi bir tabloda kontrol
edilerek tablodaki verilerin IUPAC sistemine uygun olup olmadığı anlaşılabilir;
uygun değilse gerekli değişiklikler yapılabilir.
Bir hücrenin elektrotları arasındaki potansiyel farkı,
meydana gelecek hücre reaksiyonunu belirler; fark ne kadar pozitifse
reaksiyonun sağ tarafa yönlenmesi o kadar fazladır.
Standart serbest enerji değişimi DG0, herhangi bir reaksiyonun sabit basınç ve sabit
sıcaklıkta eğilimini gösterir. Bu nedenle DG0 ve DE0 aynı şeyleri ölçer ve aşağıdaki eşitlikle
tanımlanır.
DG: serbest enerji değişimi, joule, n: elektron sayısı, mol
elektron, F: Faraday sabiti, coulomb/mol elektron, E: potansiyel, volt, joule/Coulomb.
Serbest enerji değişimi DG, DG0’dan
daha negatiftir, dolayısıyla E değeri de E0’dan daha pozitiftir.
Genel Nernst eşitliğinde, Gibb’s serbest enerjisi DG ve bir kimyasal sistemdeki elektromotor kuvvet (EMF) ilişkisi verilir.
Gümüş/gümüş klorür elektrotu elektrot potansiyelinin klorür
konsantrasyonu ile nasıl değiştiği (14) denkleminde görülmektedir.
Daha genel bir ifade çıkarabilmek için aşağıdaki yarı -
hücre reaksiyonunu inceleyelim.
Büyük harfler yarı-hücre reaksiyonundaki reaksiyona giren
yüklü veya yüksüz maddeleri, e elektronu, küçük harfler de her bir maddenin mol
sayısını gösterir. Gümüş/Gümüş klorür elektrotunda olduğu gibi, benzer
yorumlarla,
ifadesi elde edilir.Oda sıcaklığında (298 K) logaritmanın
önündeki sabitler joule/coulomb (veya volt) olarak toplanır:
Logaritma da e tabanından 2.303 ile çarpılarak on tabanına
çevrilir ve eşitlik aşağıdaki şekle dönüştürülür.
[ ] işareti altında bulunan a, daha önce de değinildiği gibi
konsantrasyonların denge konsantrasyonları olmadığını belirtmektedir. Bundan
sonra kolaylık yönünden a alt kodu kullanılmayacak, ancak bu tip denklemlerdeki
[ ] işareti içindeki verilerin denge sabitleri olmadığı da bilinecektir.
Denklem (15)'de [ ] işareti içindeki terimler R örneği
üzerinde incelenirse, aşağıdaki anlamlarda olabilirler: R bir gaz ise, [R]
gazın kısmi basıncıdır (atm).R bir madde ise, [R] maddenin konsantrasyonudur (mol/lt).
En çok karşılaşılanı, [R] nin aR (R nin aktivitesi) olması halidir.
R saf katı, sıvı veya solvent ise, [R] = 1.00 dir.
Denklem(15)'e Nernst denklemi denir ve aşağıdaki örneklerle
açıklanabilir.
(a)
Buradaki elektrot potansiyeli, demir(II) ve demir(III)
içeren bir çözeltiye inert bir metal elektrot daldırılarak ölçülebilir.
Potansiyel, iki iyonun molar konsantrasyonları arasındaki orana bağlıdır.
(c)
Bu örnekte pH2, elektrot yüzeyindeki hidrojenin
kısmi basıncıdır (atmosfer olarak). Tabii olarak pH2 atmosfer basıncına çok yakın bir değerdir.
(d)
Burada potansiyel sadece krom(III) ve dikromat (Cr2O7)
iyonları konsantrasyonuna değil, aynı zamanda çözeltinin pH ına da bağlıdır.
Örneğin, metalik bakırın çözünmesi reaksiyonunda,
Bakır iyonu konsantrasyonu azaldıkça E değeri daha pozitif olacağından
reaksiyonun gerçekleşme eğilimi artar; daha seyreltik çözeltide, reaksiyon daha
fazla ilerler.
Şekil-12: Metalik bakırın çözünmesi-potansiyel ilişkisi
Denklem(15)'de logaritmik terim sıfır olduğu zaman E
yarı-hücre potansiyeline eşit olur. Bu durum, aktivite 1 olduğu zaman, yani tüm
reaksiyona giren ve reaksiyondan çıkan maddelerin aktiviteleri 1 olduğunda
gerçekleşir. Buna göre standart potansiyel, reaksiyona giren ve reaksiyondan
çıkan ürünlerin aktivitelerinin 1 olması durumunda, yarı-hücre reaksiyonunun
(SHE'na karşı) elektrot potansiyelidir, şeklinde tarif edilir.
Standart elektrot potansiyeli önemli bir fiziksel sabittir;
bir yarı-hücre reaksiyonunun bağıl ilerleme gücünün kantitatif bir ifadesidir.
Bu sabitle ilgili bazı özellikler daima akılda tutulmalıdır:
(1) standart
elektrot potansiyeli sıcaklığa bağımlıdır; ölçümün yapıldığı sıcaklık
belirtilmelidir,
(2) standart
elektrot potansiyeli bağıl bir değerdir; yani anot yerinde, potansiyeli sıfır
olan standart hidrojen elektrotunun bulunduğu bir elektrokimyasal hücrenin
potansiyelidir,
(3) standart
potansiyelin işareti, yarısında standart hidrojen elektrotu bulunan bir
galvanik hücrenin diğer yarısındaki iletkenin işareti ile aynıdır,
(4) standart
potansiyel, bir yarı-reaksiyonun yürütücü gücünün şiddetini belirtir.
Yarı-hücre reaksiyonu yazılırken iyon, elektron ve yüksüz
taneciklerin solundaki rakamlar aynı ise standart potansiyel değerini
etkilemez. Örneğin aşağıdaki işlemin standart potansiyeli (konsantrasyona bağlı
olmasına rağmen), yarı-hücre reaksiyonunun (a) veya (b) şeklinde yazılmasından
etkilenmez:
Nerst denklemi, yarı - hücre reaksiyonunun yazılış şekline
göre düzenlenir; (a) ve (b) reaksiyonları için Nernst denklemleri aşağıdaki
şekillerde yazılır.
Standart elektrot potansiyeli, pek çok yarı-hücre reaksiyonu
için söz konusudur. E değeri hücrenin diğer yarısına hidrojen veya başka bir
referans elektrot konularak hücre voltajının ölçülmesiyle saptanır. Başka bir
hesaplama yönteminde ise yükseltgenme-indirgenme sistemlerinin denge halleri ve
bu reaksiyonların termodinamik verilerinden yararlanılır. Literatürde hesaplama
yöntemlerine göre çok sayıda değer bulunabilir.
Tablo-2'de fikir edinmek amacıyla bazı standart elektrot
potansiyel değerleri verilmiştir. Tablodaki E0 değerleri yukarıdan
aşağı inildikçe azalmaktadır. Üst sol kısımdaki reaksiyonlar, E0
değerleri yüksek olduğundan kolay oluşan indirgenme reaksiyonlarıdır; yani bu
maddeler(Cl2, O2,
Br2) kuvvetli yükseltgendirler. Tabloda aşağı doğru inildikçe
her bir madde, kendisine göre daha üstteki reaksiyonda bulunan maddeye göre
daha zayıf elektron yakalayıcıdır. Tablonun alt kısmındaki yarı-hücre
reaksiyonlarında ise reaksiyon yazılış yönünde değil ters yönde oluşur; yani bu
reaksiyonlara giren maddeler etkin indirgeyicilerdir ve reaksiyonun sağında
bulunan madde yükseltgenir. Standart potansiyellerin tablolarda toplanması,
elektron transfer reaksiyonlarının yönü hakkında kalitatif bir yorum
yapılmasına olanak verir. Örneğin, Tablo-2'den bakılarak çinkonun kadmiyuma
kıyasla daha kolay yükseltgendiği ve bu nedenle kadmiyum iyonları bulunan bir
çözeltiye metalik çinko daldırıldığında metalik kadmiyumun toplanacağı yorumu
kolaylıkla yapılabilir. Veya tersine burada kadmiyumun çinko iyonlarını
indirgeme gücünün çok zayıf olduğu söylenebilir. Başka bir örnek, demir(3)
iyonlarının triiyodür iyonlarına kıyasla daha iyi oksitleyici olduğudur; buna
göre, demir(III), iyodür, demir(II) ve triiyodür iyonlarının bulunduğu denge
halindeki bir karışımda demir(2) ve triiyodür iyonlarının hakim olduğu
söylenebilir.
Tablo-2: Standart Elektrot Potansiyelleri (25 0C’de)
Reaksiyon
|
E0,
V
|
Reaksiyon
|
E0,
V
|
Cl2
(g) + 2e- « 2Cl-
|
+1.379
|
AgCl
(k) + e- « Ag (k) + Cl-
|
+0.222
|
O2
(g) + 4H+ + 4e- « 2H2O
|
+1.229
|
Ag
(S2O3)2-3+ e- « Ag (k)+ 2S2O3-2
|
+0.010
|
Br2
(sulu) + 2e- « 2Br-
|
+1.087
|
2H+
+ 2e- « H2 (g)
|
0.000
|
Br2
(sıvı) + 2e- « 2Br-
|
+1.065
|
AgI
(k) + e- « Ag (k) + I-
|
--0.151
|
Ag+
+ e- « Ag (k)
|
+0.799
|
PbSO4
(k) + 2e- « Pb (k) + SO4-2
|
-0.350
|
Fe+3
+ e- « Fe+2
|
+0.771
|
Cd+2
+ 2e- « Cd (k)
|
-0.403
|
I3-
+ 2e- « 3I-
|
+0.536
|
Zn+2
+ 2e- « Zn (k)
|
-0.763
|
Hg2Cl2(k)+2e-«2Hg (s) +2Cl-
|
+0.268
|
Aşağıda yarı-hücre potansiyellerinin hesaplanmasında Nernst
denkleminin kullanılmasına tipik örnekler verilmiştir.
ÖRNEK.10
0.0100M Cd+2 çözeltisine daldırılmış kadmiyum
elektrotu bulunan bir yarı-hücrenin potansiyeli nedir?
Tablo-2'den,
Buna göre Nernst denklemi yazılır ve [Cd+2]
yerine 0.0100 M konsantrasyon değeri konularak yarı-hücrenin potansiyeli
hesaplanır.
Potansiyel değerinin işareti, bu yarı-hücrenin standart
hidrojen elektrotu ile birarada bulunması durumunda reaksiyonun yönünü
belirtir. Burada işaret negatif olduğundan kendiliğinden reaksiyon ters yönde
olur.
Hesaplanan potansiyelin, standart elektrotun potansiyeline
göre daha büyük negatif bir değer olduğuna dikkat edilmelidir. Bu özellik,
aşağıdaki reaksiyonun, Cd+2 konsantrasyonu azaltıcı yönde yürüme
şansını çok düşürür.
ÖRNEK.11
Br2 ile doyurulmuş 0.0100M KBr çözeltisi içine
daldırılmış platin bir elektrotun potansiyeli nedir?
Buradaki yarı-hücre reaksiyonu:
Tüm işlem için Nerst denklemi:
Burada Br2 un saf sıvı içindeki aktivitesi
sabittir ve 1.00 e eşittir. Buna göre
ÖRNEK.12
0.0100N KBr ve 1.00 x 10-3 M Br2
karışımı bir çözeltiye daldırılan platin elektrotun potansiyeli nedir?
Burada, bir önceki örnekte görülen yarı-reaksiyon
uygulanamaz, çünkü çözelti Br2 ile doygun halde değildir. Aşağıdaki
yarı-reaksiyon yazılır (Tablo-2).
Parantez içindeki (suda) terimi, Br2 un tamamının çözeltide olduğunu belirtir;
Yani Br- ve Br2 çözeltisinin aktiviteleri 1.00 mol/lt
olduğu zaman yarı-hücrenin elektrot potansiyeli 1.087 V'dur. Oysa Br2
un 25 0C'deki sudaki çözünürlüğü sadece 0.18 mol/lt dir. Bu nedenle
E0 = 1.087 V değeri, deneysel olarak gerçekleştirilmesi mümkün
olmayan nazari bir sisteme göre bulunmuştur. Bu değer yine de önemlidir, çünkü
doymamış sistemlerin potansiyellerinin hesaplanmasına olanak verir.
Burada Br2 aktivitesi doygun çözeltide olduğu
gibi, 1.00 değil, 1.00 x 10-3 dür.
Aşağıdaki örnekte görüldüğü gibi elektrot reaksiyonuna
yardımcı olan maddelerin reaksiyonunun potansiyeline etkisi önemlidir.
ÖRNEK.
13
Gümüş iyodür ile doygun olan ve iyodür aktivitesi tam 1.00
olan bir çözeltiye daldırılmış gümüş elektrotun potansiyeli nedir (AgI'ün
çözünürlük çarpımı sabiti Kçç = 8.3 x 10-17 dir)?
[Ag+] değerini, çözünürlük çarpımı sabitinden
hesaplayabiliriz.
Nernst denkleminde yerine
konur :
Burada [I-] yerine 1.00, Kçç yerine de
8.3 x 10-17 konularak E değeri bulunur.
Bu örnek, gümüş iyonunun indirgenmesindeki yarı-hücre
potansiyelinin, iyodür iyonlarının bulunması halinde daha düşük olduğunu
gösterir. Bu hal, gümüş iyonları konsantrasyonunun azalmasının, bu iyonların
indirgenme yeteneğinin de azalmasına sebep olması bakımından beklenen bir
durumdur.
Denklem(16), bir gümüş elektrot potansiyelinin gümüş iyodür
ile doygun bir çözeltideki iyodür iyonları konsantrasyonu ile ilişkisini
göstermektedir. İyodür iyonu aktivitesi 1 olduğu zaman potansiyel iki sabitin
toplamı olur; böylece aşağıdaki yarı-hücre reaksiyonunun standard elektrot
potansiyeli ile aynı olur.
Bu reaksiyon için,
Gümüş iyodür ile doygun bir çözeltideki gümüş elektrotun
Nernst denklemi aşağıdaki şekilde yazılabilir
Böylece gümüş elektrotun potansiyeli ya gümüş iyonu
konsantrasyonu ile veya iyodür iyonu konsantrasyonu ile tanımlanabilir. Son
tanımlama şekli daha uygundur.
Gümüş iyonu ile çözünebilir bir kompleks oluşturan iyon
içeren bir çözeltideki gümüş elektrotun potansiyeli de öncekine benzer bir
durum gösterir. Örneğin, tiyosülfat ve gümüş iyonlarının bulunduğu bir
çözeltide kompleks reaksiyonu oluşur:
Burada Kol kompleks oluşum sabitidir (Kf
ile de gösterilebilir). Böyle bir çözeltide gümüş elektrot için yarı-reaksiyon
aşağıdaki şekilde yazılır.
Bu yarı-reaksiyonun standard elektrot potansiyeli, hem
kompleks ve hem de komplekse giren anyonun aktiviteleri 1 olduğu zamanki
elektrot potansiyeli olacaktır. Bir önceki örnekteki yorumlar yapılarak,
Elektroanalitik işlemlerin anlaşılmasında standart elektrot
potansiyelleri büyük önem taşır. Bu değerler kullanılırken bazı sınırlamaların
bilinmesi de zorunludur.
Aktivite
Yerine Konsantrasyon Kullanılması: Nernst denkleminde reaksiyon ortamındaki maddelerin aktiviteleri
yerine çoğunlukla molar konsantrasyon değerleri kullanılır. Oysa bu iki ifade
ancak çok seyreltik çözeltiler durumunda eşit kabul edilebilir; elektrolit
konsantrasyonu arttıkça molar konsantrasyona göre hesaplanan potansiyeller,
deneysel yöntemlerle elde edilen değerlerden farklılıklar gösterir. Bu durum
standart elektrot potansiyeli +0.771 V olan,
yarı-reaksiyonunda görülebilir. Bu reaksiyonun anlamı
aktiviteler dikkate alınmadığı durumda, 1M demir(2), demir(3) ve perklorik asit
çözeltisine daldırılan bir platin elektrotun standart hidrojen elektrotuna
karşı potansiyeli +0.771 V'dur. Gerçekte ise deneysel yöntemlerle elde edilen
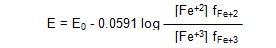
potansiyel +0.732 V olur. Bu farklılığın nedeni Nernst denkleminin aşağıdaki şekilde yazılmasıyla
açıklanabilir.
Burada fFe+2 ve fFe+3, Fe(2) ve Fe(3)
ün aktivite katsayılarıdır. Sistemdeki bu iki maddenin aktivite katsayıları,
perklorik asit ve demir tuzlarının yüksek iyonik şiddetleri nedeni ile 1'den
küçüktür. Daha da önemlisi iyonik şiddetlerin aktivite katsayılarına etkisi,
iyonun yükü arttıkça artar; bu nedenle Fe(3) iyonunun aktivite katsayısı Fe(2)
iyonununkinden daha küçüktür. Nernst denklemindeki aktivite katsayılarının
oranı bu durumda 1'den büyük olacağından yarı hücrenin potansiyeli de standart
potansiyelden küçük olur.
İyon aktivite katsayıları değerleri çoğunlukla
yükseltgenme-indirgenme titrasyonları için verilmiştir ve elektrokimyasal
çalışmalar için uygun değildir; bu nedenle pek çok hesaplamalarda aktivite
yerine molar konsantrasyon kullanılır ve tabii sonuçlar da bir miktar hatalı
olur.
Diğer
Denge Olaylarının Etkisi: Standart elektrot potansiyelleri, reaksiyon ortamındaki
maddelerin hidroliz, ayrışma (disosiyasyon), birleşme (asosiyasyon) ve kompleks
oluşumu gibi reaksiyonlara girmesi halinde karmaşık bir durum gösterir. Bu gibi
yan reaksiyonların etkilerini düzeltmek için gerekli denge sabitleri çoğunlukla
bilinemez. Böyle bir probleme iyi bir örnek ferrosiyanür/ferrisiyanür iyon çiftidir.
Bu yarı-reaksiyonda hidrojen iyonu bulunmamasına rağmen,
deneysel olarak ölçülen potansiyel ortamın pH'ından önemli derecede etkilenir.
Böylece beklenen +0.356 V değeri yerine, aynı konsantrasyonda ferrosiyanür ve
ferrisiyanür iyonları için ortamda 0.1M ve 0.01M HCl asit bulunması halinde
sırasıyla +0.71, +0.56 ve +0.48 V potansiyel bulunur (standard hidrojen
elektrotuna karşı). Potansiyel farklılıkları ferrosiyanür ve ferrisiyanür
iyonlarının hidrojen iyonu ile birleşmesinden (denge reaksiyonu) ileri gelir.
Hidroferrosiyanik asitler hidroferrisiyanik asitlerden daha zayıftır; bu
nedenle asit konsantrasyonu artırıldığında ferrosiyanür iyonlarının
konsantrasyonu ferrisiyanür iyonlarından daha az kalır. Bu etki, yükseltgenme-indirgenme
dengesini sağa kaydırır ve daha yüksek pozitif elektrot potansiyeli meydana
gelir.
Demir(3)/demir(2) çiftinin potansiyelinde de benzer bir
davranışla karşılaşılır. Eşdeğer normalitede demir(3) ve demir(2) iyonları ile
1N perklorik asit karışımının elektrot potansiyeli +0.73 V'dur. Perklorik asit
yerine aynı konsantrasyonda hidroklorik asit konulması durumunda potansiyel
+0.70 V'a, fosforik asit durumunda ise +0.6 V'a düşer. Bu farklılıklar demir(3)
iyonunun klorür ve fosfat iyonları ile demir(2) iyonuna kıyasla çok daha
kararlı kompleksler oluşturmasından dolayıdır. Sonuçta çözeltideki kompleks
oluşturmamış demir(3) iyonlarının konsantrasyonu, kompleks oluşturmamış
demir(2) iyonlarının konsantrasyonundan daha az olacağından gözlenen potansiyel
de daha düşük olur.
Bu tip olaylar ve denge reaksiyonları ve sabitleri
biliniyorsa düzeltmeler yapılabilir. Çoğu zaman gerekli bilgiler bulunamaz;
kimyacı bu gibi etkileri ihmal eder ve elde edilen sonuçlarda önemli hatalar
olmadığı kabul edilir.
Oluşum
Potansiyelleri: Aktivite
etkilerinden ve yan reaksiyonlardan oluşan hataları dengeleyebilmek için
yükseltgenme-indirgenme hesaplarında standart elektrot potansiyeli yerine
"oluşum potansiyeli" olarak adlandırılan değer kullanılır. Bir
sistemin oluşum potansiyeli, reaksiyona giren ve reaksiyondan çıkan maddelerin
konsantrasyonlarının 1N olduğu ve çözeltideki diğer maddelerin konsantrasyonlarının
da tam olarak belirtildiği durumda, yarı-hücrenin standart hidrojen elektrotuna
karşı gösterdiği potansiyeldir. Örneğin, demir(3) ün indirgenmesinde 1N perklorik
asit kullanılırsa oluşum potansiyel +0.732 V, 1N hidroklorik asit kullanılırsa
+0.700 V'dur; benzer şekilde, ferrisiyanür iyonların indirgenmesinin oluşum potansiyeli
1N hidroklorik asit ile +0.71 V, 0.01M hidroklorik asit ile +0.48 V'dur. Nerst
denkleminde standart elektrot potansiyeli yerine bu değerlerin kullanılmasıyla
hesapla ve deneysel olarak elde edilen sonuçlar birbiriyle daha uyumlu olur. Ancak
elektrolit konsantrasyonu ve türü çok büyük farklılıklar gösteren sistemlerde
oluşum potansiyeli uygulaması, standart potansiyel uygulamasına göre daha büyük
hatalara neden olabilir. Hangi şartlarda hangi potansiyelin kullanılmasının
uygun olacağı bilinmelidir.
Reaksiyon
Hızları: Elektrot
potansiyelleri tablolar halinde düzenlenmiştir. Bir yarı-reaksiyonun böyle bir
tabloda bulunması, potansiyeli bu değerde olan gerçek bir elektrotun varlığı
anlamına gelmez.
Tablolardaki verilerin pek çoğu, bir elektrot sisteminin
gerçek potansiyel ölçümlerinden değil denge konumları veya termal ölçmelere
göre yapılan hesaplarla çıkarılmıştır. Bazıları için uygun bir elektrot yoktur;
böyle hallerde aşağıdaki reaksiyonunun standart elektrot potansiyeli dolaylı
olarak bulunur.
Reaksiyon tersinir değildir ve karbon dioksitin okzalik asit
oluşturmak için birleşme hızı ihmal edilir düzeydedir. Potansiyeli reaksiyona
giren ve reaksiyondan çıkan maddelerin aktivite oranlarına göre değişen bir
elektrot sistemi yoktur. Buradaki potansiyel sadece hesaplamalarda kullanılmak
amacıyla verilmiştir.